ORYZON anuncia sus resultados y avances en el tercer trimestre de 2025
ORYZON MEJORA SU RESULTADO EN 1M€ TRAS LA FINALIZACION DEL ACUERDO DE FINANCIACION CON NICE&GREEN Y LA RECEPCION DE LA SUBVENCIÓN IPCEI HASTA EL TERCER TRIMESTRE DE 2025
- El resultado neto mejora en 1,0M€ con respecto al cierre del tercer trimestre del ejercicio precedente, situándose en una pérdida de 1,3M€ frente a 2,3 M€ recogida en septiembre de 2024
- Las inversiones en I+D aumentan en un 23,2% (1,9M€) con respecto al del tercer trimestre del ejercicio 2024. Las actividades de I+D en los nueve primeros meses del año 2025 han ascendido a 8,2 M€, de los cuales 7,5M€ corresponden a desarrollo y 0,7M€ corresponden a investigación.
- Al cierre del tercer trimestre de 2025 el efectivo y las inversiones financieras disponibles ascienden a 34,4 M€
MADRID, ESPAÑA y CAMBRIDGE, EE.UU., 7 de noviembre de 2025 – Oryzon Genomics S.A., compañía biofarmacéutica de fase clínica y líder europeo en epigenética, ha anunciado hoy sus resultados y avances en el tercer trimestre de 2025.
“Hemos obtenido más de 60 millones de dólares en la primera mitad de 2025, lo que representa un importante punto de inflexión para Oryzon”, ha comentado el Dr. Carlos Buesa, CEO de Oryzon. “Estos fondos nos permitirán avanzar en nuestros programas clínicos con un renovado enfoque estratégico en sistema nervioso central, especialmente en nuestros estudios en TLP, esquizofrenia y TEA.”
“Tras los comentarios recibidos de la FDA, la Compañía ha reforzado sus equipos clínico, estratégico y regulatorio incorporando profesionales de amplia experiencia y profundo conocimiento en el desarrollo clínico en fases avanzadas y en las interacciones con la FDA y la EMA”, ha continuado el Dr. Buesa. “Como parte de nuestro plan estratégico para convertirnos en una compañía centrada en SNC y para seguir fortaleciendo nuestro balance, estamos explorando posibles alianzas para nuestro prometedor activo en oncología-hematología, iadademstat. Continuamos incrementando su valor mediante colaboraciones en curso y la generación de nuevas evidencias clínicas bajo nuestro acuerdo CRADA con el NCI, que requiere únicamente un compromiso financiero mínimo por parte de la Compañía.”
“Los resultados impresionantes obtenidos en LMA en primera línea con la triple combinación de venetoclax, azacitidina e iadademstat —que no mostraron toxicidades limitantes de dosis y alcanzaron una tasa de respuesta global del 100%— ilustran claramente el éxito de esta estrategia”, ha añadido el Dr. Buesa. “Esperamos que los resultados adicionales prometedores en síndrome mielodisplásico y otros estudios seguirán demostrando la relevancia clínica de iadademstat en diferentes neoplasias hematológicas. Creemos que los datos que se presentarán en el congreso ASH, junto con los próximos resultados en anemia falciforme, reforzarán nuestros esfuerzos por identificar al socio adecuado que garantice que este fármaco llegue finalmente a los pacientes.”
EVOLUCIÓN DEL NEGOCIO
Tercer trimestre y otros destacados recientes
Vafidemstat:
- Tras la presentación en junio ante la Food & Drug Administration de EE.UU. (FDA) del protocolo del ensayo clínico PORTICO-2 de Fase III con vafidemstat en Trastorno Límite de la Personalidad (TLP) para su aprobación, la Compañía recibió en octubre comentarios por escrito de la FDA. Las indicaciones de la FDA abarcan distintos aspectos, como la selección de los criterios de valoración del estudio y ciertas consideraciones no clínicas. Oryzon incorporará estas recomendaciones y volverá a presentar el protocolo revisado de Fase III.
- Como parte de nuestra preparación estratégica para avanzar en nuestra cartera de productos en fases avanzadas y mejorar el diálogo con la FDA y la EMA, la Compañía ha reforzado sus equipos clínico, estratégico y regulatorio incorporando a profesionales de gran experiencia como Asesores Sénior: la Dra. Iman Barilero, quien aporta una amplia experiencia en el ámbito del SNC tras sus nueve años como Directora Global de Asuntos Regulatorios en Lundbeck y que actuará como Directora de Asuntos Regulatorios; el Dr. Christopher Breder, con dilatada experiencia en el desarrollo de fármacos y que también trabajó varios años de su carrera como Médico Evaluador en la FDA; y el Dr. Raymond Sanchez, ex Director Médico de Cerevel Therapeutics. La Compañía tiene previsto incorporar a más expertos para reforzar aún más sus capacidades de desarrollo.
- Estas incorporaciones siguen a la reciente integración de distinguidos expertos clínicos y académicos en nuestro Comité Asesor Clínico (CAB), entre ellos el Dr. Alan Schatzberg (Presidente del Departamento de Psiquiatría y Ciencias del Comportamiento de la Universidad de Stanford entre 1991 y 2010 y actual Director del Stanford Mood Disorders Center), el Dr. Eric Hollander (Catedrático de Psiquiatría y Ciencias del Comportamiento en el Albert Einstein College of Medicine y Director del Programa de Autismo y Espectro Obsesivo-Compulsivo), el Dr. Emil Coccaro (Catedrático de Psiquiatría en la Facultad de Medicina de la Ohio State University y fue Catedrático del Departamento de Psiquiatría y Neurociencia del Comportamiento de la Universidad de Chicago (2004-2016)), y la Dra. Sarah Fineberg (Profesora Adjunta de Psiquiatría en la Universidad de Yale).
- Oryzon está preparando un nuevo ensayo de Fase II para evaluar vafidemstat en el tratamiento de la agresividad en pacientes con trastorno del espectro autista (TEA). Este ensayo, denominado HOPE-2, prevé incluir, entre otros, subpoblaciones de TEA definidas genéticamente, como individuos con el síndrome de Phelan-McDermid (PMS), y se llevará a cabo inicialmente en España como parte de las actividades respaldadas por la iniciativa europea IPCEI Med4Cure recientemente concedida. En paralelo a sus esfuerzos de desarrollo clínico en TEA y PMS, Oryzon colabora como patrocinador del primer estudio sobre carga de la enfermedad del PMS, liderado por CureShank, una organización de apoyo a la investigación fundada por familias de personas afectadas por PMS. Este estudio, recientemente iniciado, tiene como objetivo caracterizar la carga directa e indirecta del PMS para los pacientes, cuidadores y el sistema sanitario estadounidense.
- El ensayo clínico de Fase IIb EVOLUTION con vafidemstat en pacientes con esquizofrenia ha continuado reclutando pacientes. Este estudio tiene como objetivo evaluar la eficacia de vafidemstat, centrado principalmente en la mejora de los síntomas negativos. Como objetivos secundarios el ensayo explorará la eficacia de vafidemstat para mejorar el deterioro cognitivo y síntomas positivos de la esquizofrenia. Inicialmente realizado únicamente en España, el estudio se está expandiendo ahora para incluir también otros países de la Unión Europea.
- Oryzon ha seguido reforzando su cartera de patentes para vafidemstat durante este trimestre, con una nueva comunicación de “Decisión de concesión” por parte de la Oficina Europea de Patentes. Las reivindicaciones aprobadas cubren el uso de vafidemstat para el tratamiento de la agresividad y el retraimiento social asociados a enfermedades del SNC, incluyendo reivindicaciones específicamente dirigidas al tratamiento de la agresividad asociada a TLP, TEA, enfermedad de Alzheimer y otras patologías, así como reivindicaciones orientadas al tratamiento del retraimiento social asociado a enfermedades como la esquizofrenia o el TEA. Una vez concedida formalmente, esta patente permanecerá en vigor al menos hasta 2038, sin incluir posibles extensiones del plazo de protección. Se han concedido o aprobado ya patentes adicionales de esta familia en Europa, Australia, Canadá, Hong Kong, Israel, Corea, Malasia, Filipinas y Rusia, y hay solicitudes en trámite en otros países.
Iadademstat:
- La combinación triple de iadademstat con venetoclax y azacitidina alcanzó una tasa de respuesta global (ORR) del 100% (n=8) en un ensayo clínico de Fase I de búsqueda de dosis en pacientes con leucemia mieloide aguda (LMA) de nuevo diagnóstico. El estudio, que continúa reclutando de forma activa, ha sido aceptado para su presentación en el próximo congreso anual de la American Society of Hematology (ASH) (6–9 de diciembre de 2025, Orlando, Florida, EE.UU.). Tal como se indica en el abstract presentado en ASH, el 88% de los pacientes alcanzó una remisión completa (CR) y el 12,5% un estado libre de leucemia morfológica (MLFS por sus siglas en inglés). Tras una mediana de seguimiento de nueve meses, la tasa estimada de supervivencia global (OS) a seis meses fue del 88%, y no se observaron toxicidades limitantes de dosis. Este estudio iniciado por investigador (IIS por sus siglas en inglés) está liderado por el Knight Cancer Institute de la Oregon Health & Science University (OHSU).
- Un segundo estudio en el mismo ámbito clínico, patrocinado por el National Cancer Institute (NCI) de EE.UU. y realizado en el marco de nuestro Acuerdo de Cooperación en Investigación y Desarrollo (CRADA) con el NCI, continúa reclutando activamente pacientes y se espera que proporcionará datos adicionales que refuercen los prometedores resultados iniciales en LMA en primera línea.
- La combinación de iadademstat con gilteritinib alcanzó una tasa de respuesta global (ORR) del 67% (8/12 pacientes) y una tasa de respuesta completa (CR + CRh + CRi) del 58% (7/12 pacientes) entre los 12 pacientes evaluables tratados con la dosis actualmente en expansión en el ensayo clínico abierto, multicéntrico, de Fase Ib FRIDA, en pacientes con LMA en recaída o refractaria (R/R) portadores de una mutación FLT3 (FLT3mut+). La actividad observada a esta dosis fue superior tanto a los datos históricos como a los datos del mundo real reportados para la monoterapia con gilteritinib. Tres pacientes han progresado a trasplante de células madre hematopoyéticas (HSCT). El estudio, que continúa reclutando pacientes, ha sido aceptado para su presentación en ASH-2025. El estudio se está llevando a cabo en Estados Unidos y prevé incluir aproximadamente hasta 45 pacientes. Según se indica en el abstract de ASH, 34 pacientes habían sido incluidos en el momento del corte de datos para la presentación del abstract, con cuatro cohortes de nivel de dosis evaluadas en la fase de escalado. La combinación fue tolerable a las dosis evaluadas, y el estudio ha progresado a la fase de expansión a una dosis farmacológicamente activa seleccionada. Se presentarán datos actualizados en el congreso.
- Ha comenzado el reclutamiento de pacientes en un nuevo estudio aleatorizado de Fase II de iadademstat en combinación con ASTX727 (decitabina oral + cedazuridina) en pacientes con neoplasias mieloproliferativas (MPN) en fase acelerada o blástica (AP/BP), patrocinado por el NCI en el marco del acuerdo CRADA con Oryzon. El estudio incluye una fase de escalado de dosis para identificar la Dosis Recomendada para Fase II (RP2D) de iadademstat + ASTX727, seguida de una fase aleatorizada que evaluará la eficacia de iadademstat + ASTX727 en comparación con monoterapia con ASTX727. Un abstract de tipo Trial-in-Progress (TIP) ha sido aceptado para su presentación en ASH-2025.
- Ha continuado el reclutamiento de pacientes en el ensayo IIS de Fase I de búsqueda de dosis de iadademstat en combinación con azacitidina en síndrome mielodisplásico (MDS), dirigido por el Medical College of Wisconsin (MCW), así como en el ensayo de Fase I/II de iadademstat en combinación con inhibidores de puntos de control inmunitario en pacientes con cáncer de pulmón de célula pequeña en estadio extendido (CPCP) que han recibido inicialmente quimioterapia e inmunoterapia estándar, llevado a cabo y patrocinado por el NCI en el marco del acuerdo CRADA con Oryzon.
- Más allá de la oncología, Oryzon ha ampliado la evaluación clínica de iadademstat en trastornos hematológicos no malignos, con un primer ensayo en anemia de células falciformes. Este ensayo multicéntrico, abierto, de Fase Ib, denominado RESTORE (REgulation of Sickling ThrOugh Reprogramming Epigenetics), evaluará la seguridad y la tolerabilidad de iadademstat en pacientes adultos con enfermedad de células falciformes, y determinará su dosis recomendada para Fase II (RP2D), además de evaluar el efecto de iadademstat en la inducción de la expresión de hemoglobina fetal (HbF). El aumento de HbF ya ha sido reconocido por la FDA como un criterio de valoración clínicamente relevante para el tratamiento de la anemia de células falciformes. El ensayo, recientemente aprobado por la Agencia Europea del Medicamento (EMA), ha comenzado a reclutar pacientes. El estudio se lleva a cabo en varios centros de España y prevé incluir aproximadamente 40 pacientes adultos.
- Un nuevo ensayo, que evaluará iadademstat en trombocitemia esencial, se encuentra actualmente en preparación, con la presentación de la Solicitud de Ensayo Clínico (CTA, equivalente en la UE a un IND) ante la EMA prevista para el cuarto trimestre de 2025.
- Oryzon ha reforzado su cartera de patentes de iadademstat durante este trimestre, con comunicaciones de “Decisión de concesión” por parte de las Oficinas de Patentes de Europa y Australia para las solicitudes tituladas “Combinaciones de iadademstat para terapia contra el cáncer”. Las reivindicaciones aprobadas protegen el uso de iadademstat en combinación con inhibidores de PD1 o PD-L1 para el tratamiento del cáncer, incluido el cáncer de pulmón de células pequeñas (CPCP). Una vez concedidas formalmente, las patentes permanecerán en vigor al menos hasta 2040, sin incluir posibles extensiones del plazo de protección. Una patente correspondiente ya ha sido concedida en Rusia, y existen solicitudes en trámite en Estados Unidos, Japón, China y otros territorios.
Programas en fases más tempranas:
- ORY-4001, un inhibidor muy selectivo de la deacetilasa de histonas 6 (HDAC-6), nominado como candidato a desarrollo clínico para el tratamiento de ciertas enfermedades neurológicas como la enfermedad de Charcot Marie-Tooth (CMT), la esclerosis lateral amiotrófica (ELA) y otras, sigue avanzando en los estudios IND pre-regulatorios que permitirán preparar el compuesto para estudios clínicos.
Información financiera del tercer trimestre de 2025
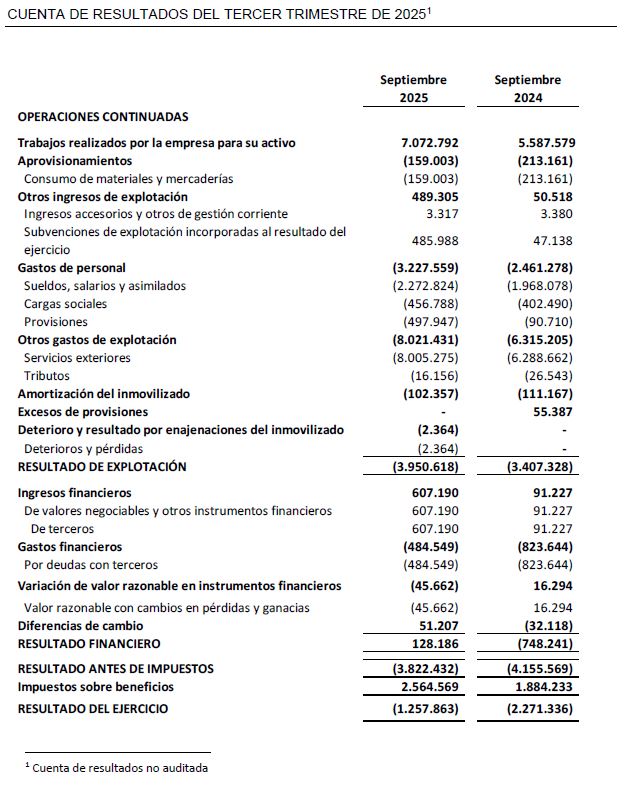
El resultado neto al cierre del tercer trimestre de 2025 se sitúa en -1,3 M€ frente al tercer trimestre del ejercicio precedente de -2,3 M€, lo que supone una mejora de 1,0M€ con respecto al cierre del tercer trimestre del ejercicio precedente.
Las inversiones en I+D en el tercer trimestre han ascendido a 8,2 M€, de las cuales 7,5 M€ corresponden a actividades de desarrollo y 0,7 M€ a actividades de investigación.
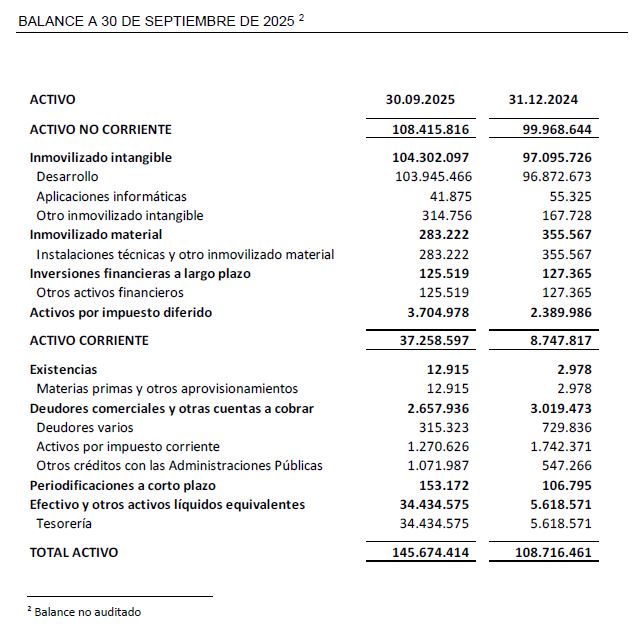
A 30 de septiembre de 2025, Oryzon mantiene efectivo e inversiones financieras disponibles por importe de 34,4 M€.
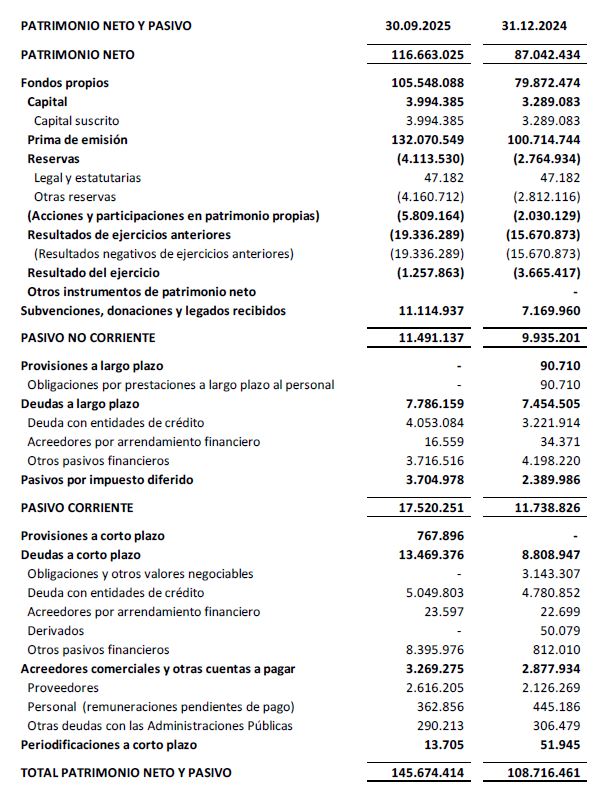
El balance a 30 de septiembre de 2025 presenta un patrimonio neto de 116,7 M€, lo que representa un incremento de un 25,9% con respecto al tercer trimestre del ejercicio precedente.
En el pasivo corriente del balance, epígrafe otros pasivos financieros, se presentan 8,4M€, de los cuales, 7,7M€ corresponden al reconocimiento de financiación anticipada correspondiente a la subvención IPCEI que se encuentra pendiente de ejecución.
Sobre Oryzon
Fundada en 2000 en Barcelona, España, Oryzon es una compañía biofarmacéutica de fase clínica líder europea en epigenética, con un fuerte enfoque en medicina personalizada para enfermedades del SNC y oncología. El equipo de Oryzon se compone de profesionales altamente cualificados de la industria farmacéutica, ubicados en Barcelona, Boston y San Diego. Oryzon tiene una cartera clínica avanzada, con dos inhibidores de LSD1, vafidemstat en SNC (listo para Fase III) y iadademstat en oncología (Fase II). La compañía tiene además otros programas dirigidos contra otras dianas epigenéticas como HDAC6, donde ORY-4001 ha sido nombrado como candidato clínico para el tratamiento de ciertas enfermedades neurológicas como CMT y ELA. La compañía posee también una fuerte plataforma para la identificación de biomarcadores y validación de dianas para una variedad de enfermedades oncológicas y neurológicas. Para más información, visitar www.oryzon.com
Sobre Iadademstat
Iadademstat (ORY-1001) es una pequeña molécula oral, que actúa como inhibidor altamente selectivo de la enzima epigenética LSD1 y tiene un potente efecto diferenciador en cánceres hematológicos (ver Maes et al., Cancer Cell. 2018 Mar 12;33(3):495-511.e12. doi: 10.1016/j.ccell.2018.02.002.). Un primer ensayo clínico de Fase I/IIa con iadademstat en pacientes con LMA recurrente o refractaria demostró la seguridad y buena tolerabilidad del fármaco y señales preliminares de actividad antileucémica, incluyendo una CRi (ver Salamero et al, J Clin Oncol, 2020, 38(36): 4260-4273. doi: 10.1200/JCO.19.03250). Iadademstat ha mostrado resultados alentadores de seguridad y potente actividad clínica en combinación con azacitidina en un ensayo de Fase IIa en pacientes ancianos con LMA de primera línea (ensayo ALICE) (ver Salamero et al., comunicación oral ASH-2022 y The Lancet Haematology, 2024, 11(7):e487-e498). Iadademstat está siendo evaluado actualmente en combinación con gilteritinib en el ensayo de Fase Ib FRIDA en pacientes con LMA refractarios/en recaida con mutaciones FLT3, y en combinación con azacitidina y venetoclax en LMA en primera línea en un ensayo iniciado por investigador (IIS) esponsorizado por OHSU y en un ensayo bajo el Acuerdo de Cooperación en Investigación y Desarrollo (CRADA) firmado con el Instituto Nacional del Cáncer (NCI) de EEUU para colaborar en el desarrollo clínico adicional de iadademstat en diferentes tipos de cánceres sólidos y hematológicos. Más allá de los cánceres hematológicos, la inhibición de LSD1 se ha propuesto como una aproximación terapéutica válida en ciertos tumores sólidos como el cáncer de pulmón de células pequeñas (CPCP), tumores neuroendocrinos (NET), meduloblastoma y otros. En un estudio de Fase IIa en combinación con platino/etopósido en pacientes con CPCP de segunda línea (ensayo CLEPSIDRA), se han reportado resultados preliminares de actividad y seguridad (ver Navarro et al, póster ESMO-2018). Iadademstat está siendo investigado en un ensayo de Fase I/II aleatorizado en CPCP en primera línea en combinación con ICI esponsorizado por NCI y liderado por el Memorial Sloan Kettering Cancer Center. Oryzon está ampliando además el desarrollo clínico de iadademstat a través de estudios clínicos adicionales iniciados por investigadores, y está expandiendo el desarrollo clínico de iadademstat también a indicaciones hematológicas no oncológicas como la anemia falciforme (reclutando pacientes) y trombocitemia esencial (estudio en preparación). Iadademstat tiene la designación de medicamento huérfano para CPCP en EEUU y para LMA en EEUU y la UE.
Sobre Vafidemstat
Vafidemstat (ORY-2001) es un inhibidor de LSD1 optimizado para SNC activo por vía oral. La molécula actúa a diferentes niveles, reduciendo el deterioro cognitivo, la pérdida de memoria y la neuroinflamación, y además ejerce efectos neuroprotectores. En modelos preclínicos vafidemstat restaura el deterioro cognitivo y elimina la agresividad exacerbada de los ratones SAMP8, un modelo de envejecimiento acelerado y Enfermedad de Alzheimer (EA), a niveles normales y también reduce la evitación social e incrementa la sociabilidad en diferentes modelos murinos. Además, vafidemstat ha mostrado una eficacia rápida, potente y duradera en varios modelos preclínicos de esclerosis múltiple (EM). Oryzon ha llevado a cabo dos estudios clínicos de Fase IIa en agresividad en pacientes con diferentes enfermedades psiquiátricas (REIMAGINE, ver Ferrer et al, Psychiatry & Clin Neurosci, 2025, doi.org/10.1111/pcn.13800) y en pacientes agitados/agresivos con EA moderado o severo (REIMAGINE-AD), con resultados clínicos positivos reportados en ambos. Otros estudios clínicos de Fase IIa con vafidemstat finalizados son el estudio ETHERAL en pacientes con EA leve o moderada, donde se demostró una disminución significativa del biomarcador de inflamación YKL40 tras 6 y 12 meses de tratamiento, y el estudio piloto, de pequeña escala SATEEN en pacientes con EM remitente-recurrente y EM secundaria progresiva, donde también se observó actividad antiinflamatoria. Vafidemstat ha sido evaluado además en un ensayo de Fase II en pacientes graves por Covid-19 (ESCAPE) donde se evaluó la capacidad del fármaco de prevenir el Síndrome de Distrés Respiratorio Agudo, una de las complicaciones más graves de la infección viral, donde mostró efectos antiinflamatorios significativos en pacientes de Covid-19 graves. Tras completar el ensayo global, aleatorizado y doble ciego de Fase IIb PORTICO en trastorno límite de la personalidad (TLP), con datos finales presentados en ECNP-2024, vafidemstat está avanzando como activo listo para Fase III en agitación/agresión en TLP (protocolo estudio Fase III presentado). Vafidemstat está siendo investigado también en un ensayo de Fase IIb doble ciego, randomizado, controlado por placebo en síntomas negativos de la esquizofrenia (el ensayo EVOLUTION; reclutando pacientes). Oryzon también está desplegando un enfoque de medicina de precisión en SNC con vafidemstat en subpoblaciones de pacientes definidas genéticamente de ciertas enfermedades del SNC, así como en síndromes del neurodesarrollo, y está preparando un ensayo clínico en agresión en pacientes con trastornos autistas como el síndrome de Phelan-McDermid.
AFIRMACIONES O DECLARACIONES CON PROYECCIONES DE FUTURO
Esta comunicación contiene información y afirmaciones o declaraciones con proyecciones de futuro sobre Oryzon. Asimismo, incluye proyecciones y estimaciones financieras con sus presunciones subyacentes, declaraciones relativas a planes, objetivos, y expectativas en relación con futuras operaciones, inversiones, sinergias, productos y servicios, y declaraciones sobre resultados futuros. Las declaraciones con proyecciones de futuro no constituyen hechos históricos y se identifican generalmente por el uso de términos como “espera”, “anticipa”, “cree”, “pretende”, “estima” y expresiones similares.
Si bien Oryzon considera que las expectativas recogidas en tales afirmaciones son razonables, se advierte a los inversores y accionistas de Oryzon de que la información y las afirmaciones con proyecciones de futuro están sometidas a riesgos e incertidumbres, muchos de los cuales son difíciles de prever y están, de manera general, fuera del control de Oryzon, lo que podría provocar que los resultados y desarrollos reales difieran significativamente de aquellos expresados, implícitos o proyectados en la información y afirmaciones con proyecciones de futuro. Entre tales riesgos e incertidumbres están aquellos identificados en los documentos remitidos por Oryzon a la Comisión Nacional del Mercado de Valores y que son accesibles al público.
Se recomienda no tomar decisiones sobre la base de afirmaciones o declaraciones con proyecciones de futuro, ya que se refieren exclusivamente a la fecha en la que se manifestaron, no constituyen garantía alguna de resultados futuros y no han sido revisadas por los auditores de Oryzon. La totalidad de las declaraciones o afirmaciones de futuro de forma oral o escrita emitidas por Oryzon o cualquiera de sus miembros del consejo, directivos, empleados o representantes quedan sujetas, expresamente, a las advertencias realizadas. Las afirmaciones o declaraciones con proyecciones de futuro incluidas en este documento están basadas en la información a disposición de Oryzon a la fecha de esta comunicación.