Oryzon anuncia sus resultados y avances en el tercer trimestre de 2023
MADRID, ESPAÑA y BOSTON, MA, EE.UU., 27 de octubre de 2023 – Oryzon Genomics, S.A., la compañía española que desarrolla terapias experimentales epigenéticas innovadoras anuncia sus resultados y avances en el tercer trimestre de 2023
ORYZON MANTIENE SU RITMO INVERSOR EN I+D EN 11,5 M€ HASTA EL TERCER TRIMESTRE DE 2023
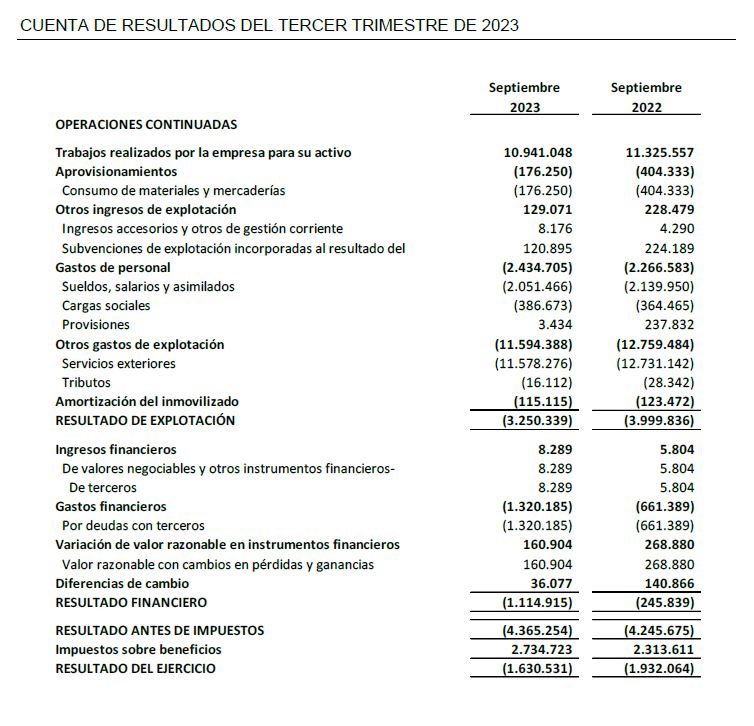
- Los ingresos relativos a trabajos realizados para el propio inmovilizado al cierre del tercer trimestre de 2023 han ascendido a 11,5 M€.
- Inversiones en I+D de 11,5 M€, de las cuales 11,0 M€ corresponden a desarrollo y 0,5 M€ a investigación, han minorado en 0,7 M€ con respecto al tercer trimestre de 2022, lo que supone una variación de un -6%.
- El resultado neto de 1,6 M€ de pérdida se encuentra acorde con la especificidad del modelo de negocio de la biotecnología, en la fase de desarrollo pre-revenues en la que se halla la Sociedad, con un periodo de maduración de sus productos a largo plazo, sin ingresos recurrencias hasta formalizar contratos de licencia.
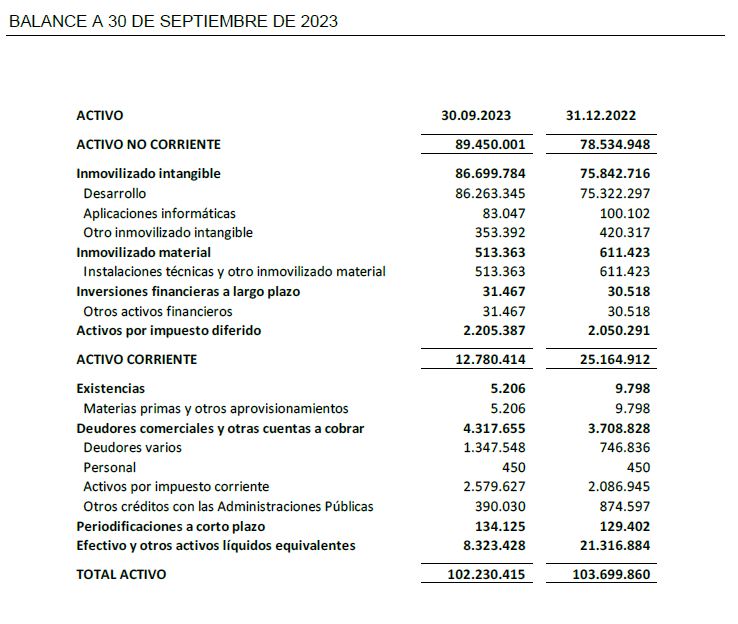
- Al cierre del tercer trimestre de 2023 el efectivo y las inversiones financieras disponibles ascienden a 8,3 M€.
EVOLUCIÓN DEL NEGOCIO
Tercer trimestre y otros destacados recientes
La compañía ha continuado avanzando en este tercer trimestre en el desarrollo clínico de sus programas de neurología vafidemstat y oncología iadademstat
Vafidemstat en grandes trastornos multifactoriales del SNC:
- Reportados datos de seguridad agregados preliminares ciegos positivos de PORTICO, el ensayo clínico de Fase IIb de vafidemstat en pacientes con Trastorno Límite de la Personalidad (TLP), en el marco del congreso del European College of Neuropsychopharmacology (ECNP), correspondientes a los primeros 198 pacientes aleatorizados (fecha de corte de los datos, 23 de agosto de 2023). A fecha septiembre de 2023, PORTICO había aleatorizado a 210 participantes, y 131 de los participantes previstos inicialmente (N = 150) ya habían completado el ensayo. Los resultados presentados en ECNP-2023 confirman que PORTICO reclutó a una población de TLP representativa del mundo real que permitía comorbilidades y medicaciones concomitantes comunes que suelen ser excluyentes en otros ensayos clínicos de TLP, además de permitir que los sujetos recibieran psicoterapia durante el ensayo. Tanto la tasa de cribado fallido en la fase de reclutamiento de pacientes como la tasa de abandono fueron inferiores a las del ensayo clínico más reciente en TLP. Por último, los datos de seguridad ciegos agregados sobre la muestra completa reclutada respaldan que vafidemstat ha sido extremadamente seguro y bien tolerado, con un bajo número de abandonos (2%) debidos a efectos adversos relacionados con el tratamiento y 0% debidos a efectos adversos graves relacionados con el tratamiento. Sólo se notificó un efecto adverso grave relacionado con el tratamiento considerado severo, que se recuperó/resolvió completamente durante el estudio.. Los datos actuales de PORTICO siguen respaldando que vafidemstat es seguro y bien tolerado. Previamente se había reportado resultados positivos del análisis provisional preespecificado de PORTICO, llevado a cabo por el Comité de Monitorización de Datos (CMD) independiente durante el primer trimestre de 2023, determinándose que el ensayo era no-fútil y debía continuar con el reclutamiento del nº de pacientes inicialmente previsto. PORTICO es un estudio de Fase IIb multicéntrico, doble ciego, aleatorizado y controlado con placebo que se lleva a cabo en EEUU y Europa para evaluar la eficacia y seguridad de vafidemstat en pacientes con TLP. El ensayo tiene dos objetivos primarios independientes: la reducción de la agresividad/agitación y la mejora global de la enfermedad. El ensayo ha completado el reclutamiento y la salida del último paciente del estudio está prevista para antes de finales de 2023. Los resultados preliminares del estudio se esperan para el primer trimestre de 2024, tras lo cual se presentarán los datos completos en un congreso de psiquiatría y se publicarán en una revista especializada.
- El ensayo clínico de Fase IIb EVOLUTION con vafidemstat en pacientes con esquizofrenia ha continuado reclutando pacientes. Este estudio de Fase IIb evaluará la eficacia de vafidemstat sobre los síntomas negativos y la cognición en pacientes con esquizofrenia. Este proyecto está parcialmente financiado con fondos públicos del Ministerio de Ciencia e Innovación español y se lleva a cabo en diversos hospitales españoles.
Vafidemstat en trastornos monogénicos del SNC:
- La compañía continúa la preparación de HOPE, un nuevo ensayo de medicina de precisión en pacientes con síndrome de Kabuki (SK). La compañía está dialogando con las agencias reguladoras para refinar el diseño final de este ensayo y espera presentar el IND para HOPE a la FDA durante 2024.
Iadademstat en oncología:
- Ha continuado el reclutamiento de pacientes en FRIDA, un ensayo clínico de Fase Ib de iadademstat en combinación con gilteritinib en pacientes con leucemia mieloide aguda (LMA) recidivante/refractaria (R/R) que albergan una mutación de la tirosina quinasa tipo FMS (FLT3mut+). Los objetivos primarios del estudio son evaluar la seguridad y tolerabilidad de iadademstat en combinación con gilteritinib en pacientes con LMA R/R con mutaciones FLT3 y establecer la dosis recomendada de Fase 2 (RP2D) para esta combinación. Los objetivos secundarios incluyen la evaluación de la eficacia del tratamiento, medida como la tasa de remisión completa y remisión completa con recuperación hematológica parcial (CR/CRh), la duración de las respuestas (DoR) y la evaluación de la enfermedad residual medible. El estudio se lleva a cabo en EEUU e incluirá hasta 45 pacientes aproximadamente. Si los resultados son favorables, la compañía y la FDA han acordado celebrar una reunión para discutir el mejor plan para seguir desarrollando esta combinación en esta población de LMA tan necesitada.
- El ensayo clínico cesta de Fase II de iadademstat en combinación con paclitaxel en cáncer de pulmón de células pequeñas (CPCP) R/R a platino y tumores neuroendocrinos extrapulmonares de alto grado (ensayo NET) ha continuado reclutando pacientes. Este ensayo se lleva a cabo en EEUU en el marco de un acuerdo de colaboración en investigación clínica con el Fox Chase Cancer Center (FCCC), en virtud del cual el FCCC realizará diferentes ensayos clínicos de combinación en colaboración con iadademstat, y Oryzon contribuirá con financiación, el fármaco y conocimientos técnicos.
- Han continuado los preparativos para el nuevo ensayo STELLAR, un ensayo de Fase Ib/II aleatorizado y multicéntrico de iadademstat con un inhibidor de punto de control inmunitario en pacientes con CPCP metastásico en primera línea. La compañía cree que STELLAR podría potencialmente apoyar una solicitud de aprobación de comercialización acelerada.
Programas en fases más tempranas:
- Se han presentado datos de eficacia preclínica positivos de ORY-4001, un inhibidor selectivo de la deacetilasa de histonas 6 (HDAC-6), en enfermedad de Charcot Marie-Tooth (CMT) en la tercera Annual Global CMT Research Convention celebrada en septiembre. El tratamiento con ORY-4001 logró revertir los síntomas de progresión de la enfermedad en un modelo de ratón de CMT que recapitula muchos de los síntomas de esta enfermedad en humanos, mejorando la mielinización y restaurando la integridad de los axones en el nervio ciático, y mejorando los potenciales de acción muscular compuestos y la conducción nerviosa en comparación con los animales no tratados. Los resultados presentados son fruto una colaboración iniciada en 2022 entre Oryzon y la CMT Research Foundation (CMTRF), una organización estadounidense sin ánimo de lucro dirigida por pacientes y centrada en ofrecer tratamientos y curas para la CMT. ORY-4001 fue recientemente nominado como candidato a desarrollo clínico para el tratamiento de ciertas enfermedades neurológicas como la CMT, la esclerosis lateral amiotrófica (ELA) y otras, y entrará ahora en estudios IND pre-regulatorios que permitirán preparar el compuesto para estudios clínicos. Los inhibidores de HDAC6 se han propuesto anteriormente como tratamientos potencialmente eficaces para CMT, la ELA y otros trastornos neurológicos que carecen de tratamientos eficaces.
Información financiera del tercer trimestre de 2023
El resultado neto al cierre del tercer trimestre de 2023 se sitúa en -1,6 M€, frente al del tercer trimestre del ejercicio precedente de -1,9 M€, lo que supone una mejora del resultado con respecto al mismo periodo del ejercicio precedente de un 15,6%.
La Inversiones en I+D en el tercer trimestre de 2023 han alcanzado una cifra de 11,5 M€, de las cuales 11,0 M€ corresponden a actividades de desarrollo y 0,5 M€ a actividades de investigación.
A 30 de septiembre de 2023, Oryzon mantiene una posición financiera con recursos disponibles por importe de 8,3 M€.
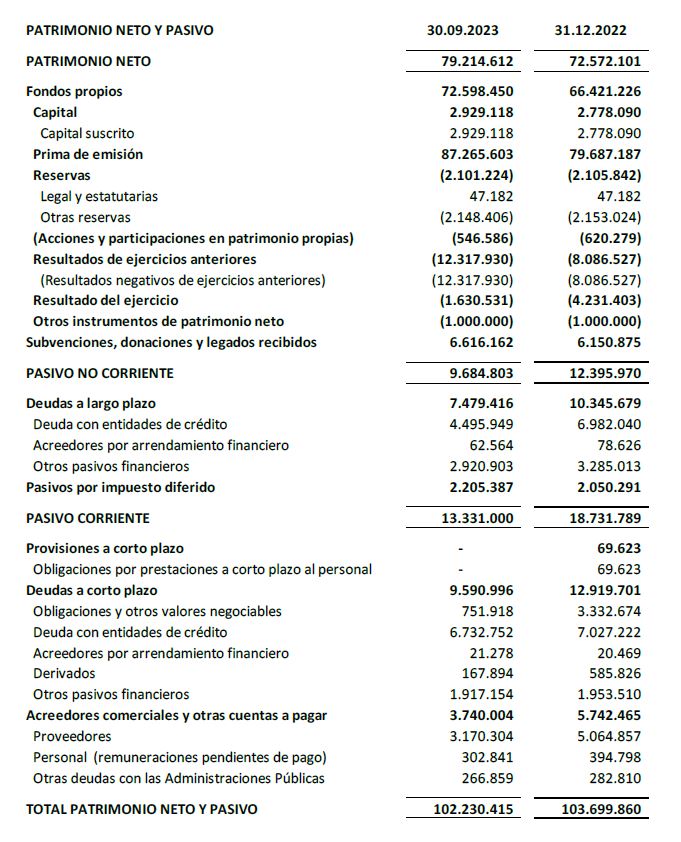
El balance a 30 de septiembre de 2023 presenta un patrimonio neto de 79,2 M€.
Sobre Oryzon
Fundada en 2000 en Barcelona, España, Oryzon es una compañía biofarmacéutica de fase clínica líder europea en epigenética, con un fuerte enfoque en medicina personalizada para enfermedades del SNC y oncología. El equipo de Oryzon se compone de profesionales altamente cualificados de la industria farmacéutica, ubicados en Barcelona, Boston y San Diego. Oryzon tiene una cartera clínica avanzada, con dos inhibidores de LSD1, vafidemstat en SNC y iadademstat en oncología, en varios ensayos clínicos de Fase II. La compañía tiene además otros programas dirigidos contra otras dianas epigenéticas. La compañía posee también una fuerte plataforma para la identificación de biomarcadores y validación de dianas para una variedad de enfermedades oncológicas y neurológicas. Para más información, visitar www.oryzon.com
Sobre Iadademstat
Iadademstat (ORY-1001) es una pequeña molécula oral, que actúa como inhibidor altamente selectivo de la enzima epigenética LSD1 y tiene un potente efecto diferenciador en cánceres hematológicos (ver Maes et al., Cancer Cell. 2018 Mar 12;33(3):495-511.e12. doi: 10.1016/j.ccell.2018.02.002.). Un primer ensayo clínico de Fase I/IIa con iadademstat en pacientes con LMA recurrente o refractaria demostró la seguridad y buena tolerabilidad del fármaco y señales preliminares de actividad antileucémica, incluyendo una CRi (ver Salamero et al, J Clin Oncol, 2020, 38(36): 4260-4273. doi: 10.1200/JCO.19.03250). En un ensayo de Fase IIa recientemente completado en pacientes ancianos con LMA de primera línea (ensayo ALICE), iadademstat ha mostrado resultados alentadores de seguridad y eficacia en combinación con azacitidina (ver Salamero et al., comunicación oral ASH-2022). Iadademstat está siendo evaluado actualmente en combinación con gilteritinib en el ensayo de Fase Ib FRIDA en pacientes con LMA refractarios/en recaida con mutaciones FLT3. Más allá de los cánceres hematológicos, la inhibición de LSD1 se ha propuesto como una aproximación terapéutica válida en ciertos tumores sólidos como el cáncer de pulmón de células pequeñas (CPCP), tumores neuroendocrinos (NET), meduloblastoma y otros. En un estudio de Fase IIa en combinación con platino/etopósido en pacientes con CPCP de segunda línea (ensayo CLEPSIDRA), se han reportado resultados preliminares de actividad y seguridad (ver Navarro et al, póser ESMO-2018). Iadademstat está siendo evaluado en un ensayo colaborativo de Fase II con el Fox Chase Cancer Center en combinación con paclitaxel en carcinomas neuroendocrinos refractarios/en recaida, y la compañía está preparando un nuevo ensayo en combinación en CPCP. Oryzon ha firmado un Acuerdo de Cooperación en Investigación y Desarrollo (CRADA) con el Instituto Nacional del Cáncer (NCI) de EEUU para colaborar en el posible desarrollo clínico adicional de iadademstat en diferentes tipos de cánceres sólidos y hematológicos. En total iadademstat ha sido administrado a más de 100 pacientes de cáncer en cuatro ensayos clínicos. Iadademstat tiene la designación de medicamento huérfano para CPCP en EEUU y para LMA en EEUU y la UE.
Sobre Vafidemstat
Vafidemstat (ORY-2001) es un inhibidor de LSD1 optimizado para SNC activo por vía oral. La molécula actúa a diferentes niveles, reduciendo el deterioro cognitivo, la pérdida de memoria y la neuroinflamación, y además ejerce efectos neuroprotectores. En modelos preclínicos vafidemstat restaura el deterioro cognitivo y elimina la agresividad exacerbada de los ratones SAMP8, un modelo de envejecimiento acelerado y Enfermedad de Alzheimer (EA), a niveles normales y también reduce la evitación social e incrementa la sociabilidad en diferentes modelos murinos. Además, vafidemstat ha mostrado una eficacia rápida, potente y duradera en varios modelos preclínicos de esclerosis múltiple (EM). Oryzon ha llevado a cabo dos estudios clínicos de Fase IIa en agresividad en pacientes con diferentes enfermedades psiquiátricas (REIMAGINE) y en pacientes agitados/agresivos con EA moderado o severo (REIMAGINE-AD), con resultados clínicos positivos reportados en ambos. Otros estudios clínicos de Fase IIa con vafidemstat finalizados son el estudio ETHERAL en pacientes con EA leve o moderada, donde se ha demostrado una disminución significativa del biomarcador de inflamación YKL40 tras 6 y 12 meses de tratamiento, y el estudio piloto, de pequeña escala SATEEN en pacientes con EM remitente-recurrente y EM secundaria progresiva, donde también se ha observado actividad antiinflamatoria. Vafidemstat ha sido evaluado además en un ensayo de Fase II en pacientes graves por Covid-19 (ESCAPE) donde se evaluó la capacidad del fármaco de prevenir el Síndrome de Distrés Respiratorio Agudo, una de las complicaciones más graves de la infección viral, donde mostró efectos antiinflamatorios significativos en pacientes de Covid-19 graves. Actualmente vafidemstat está en dos ensayos clínico de Fase IIb en pacientes con trastorno límite de la personalidad (PORTICO) y en pacientes con esquizofrenia (EVOLUTION). Oryzon también está desplegando un enfoque de medicina de precisión en SNC con vafidemstat en subpoblaciones de pacientes definidas genéticamente de ciertas enfermedades del SNC y está preparando un ensayo clínico en pacientes con el síndrome de Kabuki. La compañía también está explorando el desarrollo clínico de vafidemstat en otros síndromes del neurodesarrollo.
AFIRMACIONES O DECLARACIONES CON PROYECCIONES DE FUTURO
Esta comunicación contiene información y afirmaciones o declaraciones con proyecciones de futuro sobre Oryzon. Asimismo, incluye proyecciones y estimaciones financieras con sus presunciones subyacentes, declaraciones relativas a planes, objetivos, y expectativas en relación con futuras operaciones, inversiones, sinergias, productos y servicios, y declaraciones sobre resultados futuros. Las declaraciones con proyecciones de futuro no constituyen hechos históricos y se identifican generalmente por el uso de términos como “espera”, “anticipa”, “cree”, “pretende”, “estima” y expresiones similares.
Si bien Oryzon considera que las expectativas recogidas en tales afirmaciones son razonables, se advierte a los inversores y accionistas de Oryzon de que la información y las afirmaciones con proyecciones de futuro están sometidas a riesgos e incertidumbres, muchos de los cuales son difíciles de prever y están, de manera general, fuera del control de Oryzon, lo que podría provocar que los resultados y desarrollos reales difieran significativamente de aquellos expresados, implícitos o proyectados en la información y afirmaciones con proyecciones de futuro. Entre tales riesgos e incertidumbres están aquellos identificados en los documentos remitidos por Oryzon a la Comisión Nacional del Mercado de Valores y que son accesibles al público.
Se recomienda no tomar decisiones sobre la base de afirmaciones o declaraciones con proyecciones de futuro, ya que se refieren exclusivamente a la fecha en la que se manifestaron, no constituyen garantía alguna de resultados futuros y no han sido revisadas por los auditores de Oryzon. La totalidad de las declaraciones o afirmaciones de futuro de forma oral o escrita emitidas por Oryzon o cualquiera de sus miembros del consejo, directivos, empleados o representantes quedan sujetas, expresamente, a las advertencias realizadas. Las afirmaciones o declaraciones con proyecciones de futuro incluidas en este documento están basadas en la información a disposición de Oryzon a la fecha de esta comunicación.