Oryzon anuncia sus resultados y avances en el tercer trimestre de 2021
MADRID, ESPAÑA y CAMBRIDGE, EE.UU., 28 de octubre de 2021 – Oryzon Genomics, S.A., la compañía española que desarrolla terapias experimentales epigenéticas innovadoras anuncia sus resultados y avances en el tercer trimestre de 2021
ORYZON MANTIENE UN ALTO RITMO INVERSOR EN EL TERCER TRIMESTRE DE 2021 DE 9,6 M€
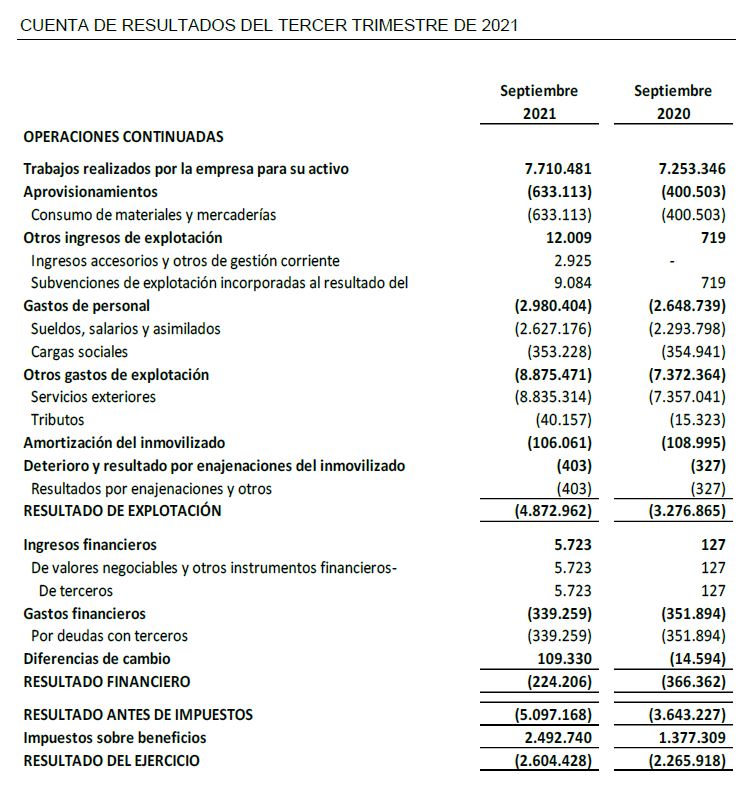
- Los ingresos relativas a trabajos realizados para el propio inmovilizado al cierre del tercer trimestre de 2021 ascienden a 7,7 M €, un 6% superiores con respecto al tercer trimestre de 2020.
- Inversiones en I+D de 9,6 M€, de las cuales 8,6 M€ corresponden a desarrollo y 1,0 M€ a investigación.
- El resultado neto de 2,6 M€ de pérdida, aumenta un 15% con respecto al mismo periodo del ejercicio anterior al haber realizado la Sociedad actividades de desarrollo no capitalizada para contribuir en la lucha contra COVID-19 en el ensayo clínico ESCAPE por importe de 0,9 M€.
- Al cierre del primer semestre el efectivo y las inversiones financieras disponibles ascienden a 30,9M€.
EVOLUCIÓN DEL NEGOCIO
Tercer trimestre y otros destacados recientes
La compañía ha continuado avanzando en este tercer trimestre en el desarrollo clínico de sus programas de oncología iadademstat y neurología vafidemstat.
Iadademstat en oncología:
- El ensayo de Fase II ALICE, que investiga el uso de iadademstat en combinación con azacitidina en leucemia mieloide aguda (LMA), ha completado el reclutamiento, con un total de 36 pacientes. Los resultados preliminares correspondientes a los 30 meses del estudio, presentados en el congreso EHA2021 el pasado mes de junio, mostraban señales robustas de eficacia clínica, con ORR del 83%, de los cuales el 67% eran CR/CRi, así como un un buen perfil de seguridad de la combinación de iadademstat y azacitidina. Las respuestas eran de larga duración, con cinco pacientes con remisiones superiores al año y la remisión más larga en aquel momento de 858 días, todavía en curso. . La empresa tiene previsto presentar una nueva actualización clínica sobre ALICE en el congreso ASH-2021.
- La compañía está preparando nuevos ensayos en combinación en LMA y tumores sólidos. En LMA, la compañía planea iniciar FRIDA, un ensayo de Fase Ib/II en abierto y multicéntrico de iadademstat en combinación con gilteritinib en pacientes con LMA con mutación FLT3 que son refractarios o que han recaído. En cáncer de pulmón de célula pequeña (CPCP), la compañía está preparando el ensato STELLAR. STELLAR es un ensayo de Fase Ib/II aleatorizado y multicéntrico de iadademstat con un inhibidor de punto de control inmunitario (ICI) en pacientes con CPCP metastásico en primera línea. Ambos ensayos se llevaran a cabo en EE.UU y ambos planean reclutar 120 pacientes. La compañía cree que FRIDA y STELLAR podrían potencialmente apoyar solicitudes de aprobación de comercialización acelerada.
Vafidemstat engrandes trastornos multifactoriales del SNC:
- La compañía está ya reclutando pacientes en EE.UU en el ensayo clínico de Fase IIb PORTICO con vafidemstat en pacientes con Trastorno Límite de la Personalidad (TLP). El estudio está actualmente reclutando pacientes de forma activa en Europa y EE.UU. PORTICO es un estudio de Fase IIb multicéntrico, doble ciego, aleatorizado y controlado con placebo para evaluar la eficacia y seguridad de vafidemstat en pacientes con TLP. El ensayo tiene dos objetivos primarios: la reducción de la agresividad/agitación y la mejora global de la enfermedad. El estudio incluirá 156 pacientes, con 78 pacientes en cada brazo, y cuenta con un análisis intermedio predefinido para ajustar el tamaño de la muestra en caso de una variabilidad excesiva en torno a las variables de evaluación o una tasa de placebo inesperadamente alta. El ensayo se llevará a cabo en 15-20 centros en Europa y Estados Unidos.
- La compañía recibió en el mes de julio la aprobación de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) para llevar a cabo un ensayo clínico de Fase IIb con vafidemstat en pacientes con esquizofrenia. Este estudio de Fase IIb, denominado EVOLUTION, evaluará la eficacia de vafidemstat sobre los síntomas negativos y la cognición en pacientes con esquizofrenia. Este proyecto está parcialmente financiado con fondos públicos del Ministerio de Ciencia e Innovación y se realizará en diversos hospitales españoles. Hemos activado varios centros clínicos durante este período.
- Se presentaron datos finales del ensayo de Fase II SATEEN sobre la capacidad de vafidemstat para reducir la respuesta inflamatoria en pacientes con esclerosis múltiple (EM) en el 37º Congreso del Comité Europeo para el Tratamiento y la Investigación de la Esclerosis Múltiple, ECTRIMS-2021. Este ensayo de Fase II, aleatorizado, doble ciego, controlado con placebo, de grupos paralelos y de búsqueda de dosis, tenía como objetivo evaluar la seguridad y la tolerabilidad de vafidemstat en pacientes con EM con recaída y remisión (EMRR) o con EM secundaria progresiva (EMSP). En el ensayo participaron 18 pacientes. El tratamiento a largo plazo con vafidemstat fue seguro y bien tolerado, con exposiciones al fármaco de hasta 2 años. SATEEN fue un ensayo piloto a pequeña escala que no tenía la potencia necesaria para obtener datos de eficacia definitivos. No hubo diferencias estadísticamente significativas entre los grupos en las evaluaciones de IRM, OCT o EDSS. No obstante, algunos pacientes tratados con vafidemstat mostraron una mejora en uno o más indicadores clínicos. Además, se observó una prometedora actividad antiinflamatoria en la mayoría de los pacientes tratados con vafidemstat en comparación con el placebo.
- Se presentaron datos preliminares del estudio clínico de vafidemstat en pacientes graves con Covid-19, llamado ESCAPE, en 31º Congreso Europeo de Microbiología Clínica y Enfermedades Infecciosas, ECCMID-2021. Este era un ensayo de Fase II abierto, aleatorizado, de doble brazo para evaluar la eficacia y la tolerabilidad de vafidemstat en combinación con el tratamiento estándar utilizado en los hospitales, para evitar la progresión a Síndrome de Distrés Respiratorio agudo, que reclutó 60 pacientes. Vafidemstat fue seguro y bien tolerado en pacientes graves de CoVID-19. Se observaron efectos antiinflamatorios de vafidemstat en pacientes graves de CoVID-19. Vafidemstat redujo la activación exacerbada de las células T CD4+ y redujo la liberación de citocinas inflamatorias. No hubo diferencias significativas en el número de fallecidos entre los dos brazos del estudio y los pacientes en ambos brazos del estudio se recuperaron con rapidez. Estos resultados antiinflamatorios obtenidos en SATEEN y ESCAPE están en consonancia con la actividad antiinflamatoria observada previamente en el ensayo ETHERAL de vafidemstat en pacientes con Alzheimer.
Vafidemstat en trastornos monogénicos del SNC:
- La compañía está preparando un nuevo ensayo de medicina de precisión en pacientes con síndrome de Kabuki (SK). Este ensayo de Fase I/II, denominado HOPE, será un ensayo multicéntrico, multibrazo, aleatorizado, doble ciego y controlado con placebo para explorar la seguridad y la eficacia de vafidemstat en la mejora de varias deficiencias descritas en pacientes con SK. El ensayo prevé reclutar a 50-60 pacientes y se realizará en niños mayores de 12 años y en adultos jóvenes. La compañía espera iniciar el HOPE en la primera mitad de 2022 en varios hospitales y centros de EE.UU y, posiblemente, en Europa. Teniendo en cuenta los precedentes de la FDA y la EMA en enfermedades raras y trastornos del SNC, creemos que si el ensayo HOPE demuestra mejoras clínicas relevantes, podría servir de base para una aprobación acelerada en la UE y en Estados Unidos.
- Continúan avanzando las colaboraciones en el campo de la medicina de precisión en autismo con investigadores del Centro Seaver de Investigación y Tratamiento del Autismo en la Facultad de Medicina Icahn en el Hospital Mount Sinai de Nueva York y con el Instituto de Genética Médica y Molecular (INGEMM) del Hospital Universitario La Paz de Madrid, y en medicina de precisión en esquizofrenia con investigadores de la Universidad de Columbia en Nueva York. Los resultados de los estudios piloto en marcha de caracterización de estos pacientes con mutaciones especificas, que servirán para informar posteriores estudios clínicos de psiquiatría de precisión con vafidemstat, se esperan para el segundo semestre de 2021.
Información financiera del tercer trimestre de 2021
El resultado neto de 2,6 M€ de pérdida, aumenta un 15% con respecto al mismo periodo del ejercicio anterior al haber realizado la Sociedad actividades de desarrollo no capitalizada para contribuir en la lucha contra COVID-19 en el ensayo clínico ESCAPE por importe de 0,9 M€.
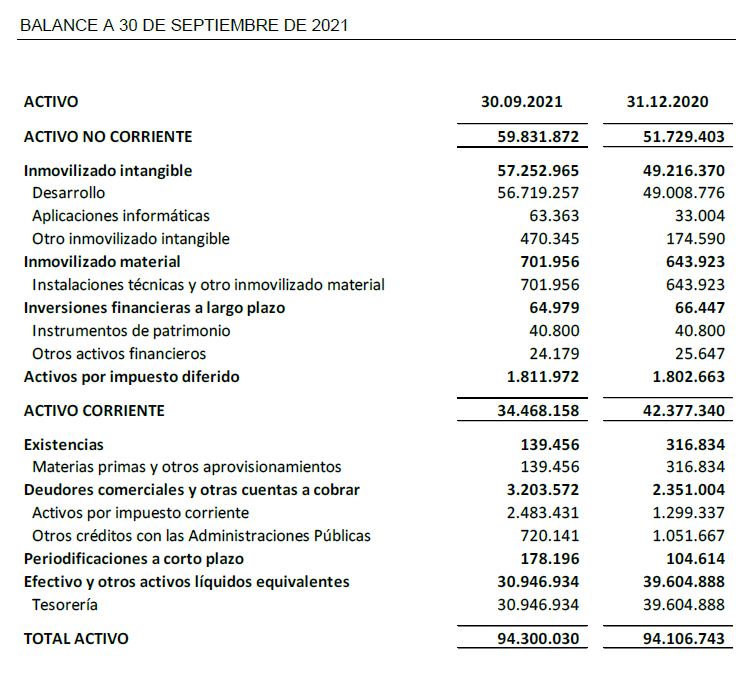
A 30 de septiembre de 2021, Oryzon mantiene una posición financiera significativamente robusta con recursos financieros disponibles por importe de 30,9 M€ que le permite continuar con el desarrollo de sus actividades de I+D y el desarrollo de sus estudios clínicos de Fase IIb.
Durante el tercer trimestre de 2021, Oryzon ha obtenido una ayuda por importe de 1,0 M de US$ para apoyar un nuevo ensayo clínico de vafidemstat en pacientes con síndrome de Kabuki (ensayo HOPE).
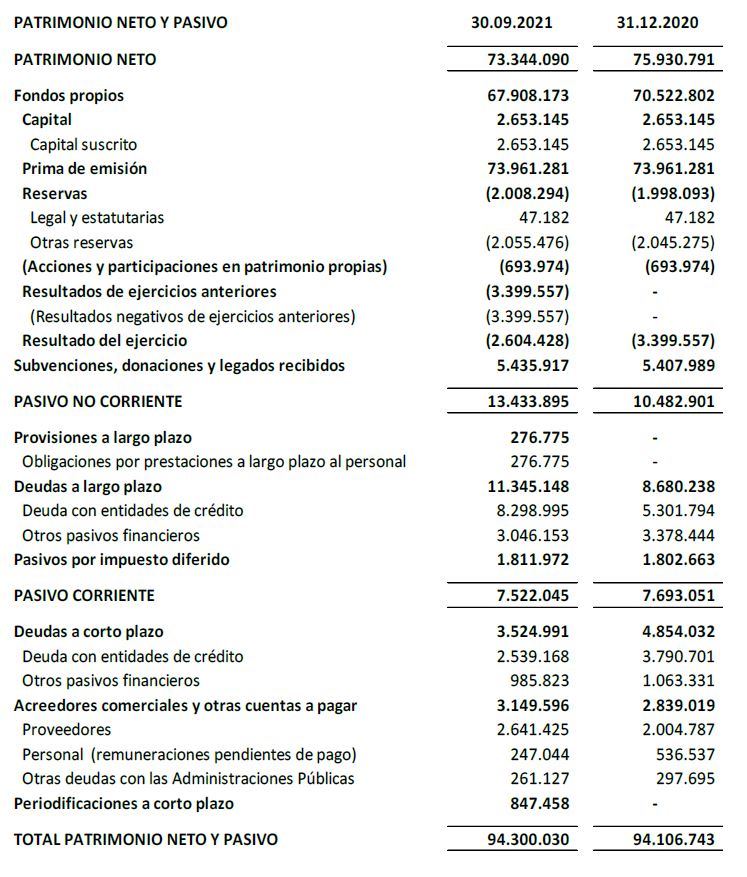
El balance a 30 de septiembre de 2021 muestra una robustez relevante con un patrimonio neto de 73,3 M€.
PRINCIPALES NOTICIAS EN EL TERCER TRIMESTRE DE 2021
A continuación, se relacionan las principales noticias publicadas a lo largo del tercer trimestre de 2021; la información completa puede consultarse en:
https://www.oryzon.com/es/noticias
9 de Julio de 2021 ORYZON presenta datos de seguridad y eficacia de vafidemstat del ensayo de Fase II ESCAPE en enfermos de CoVID-19 en el congreso ECCMID-2021
Oryzon anunció la presentación de datos preliminares de la capacidad de vafidemstat para reducir la respuesta inflamatoria en pacientes de CoVID-19 del ensayo de Fase II ESCAPE en el 31º Congreso Europeo de Microbiología Clínica y Enfermedades Infecciosas, ECCMID-2021, en una comunicación en formato póster electrónico titulada “ESCAPE trial: Preliminary data on the effect of vafidemstat treatment in the CoVID-19 induced immune response in hospitalized patients”.
13 de Julio de 2021 ORYZON recibe la aprobación para comenzar EVOLUTION: un ensayo clínico de Fase IIb con vafidemstat en esquizofrenia
Oryzon anunció la aprobación de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) de la solicitud para llevar a cabo un ensayo clínico de Fase IIb con vafidemstat en pacientes adultos con esquizofrenia. El ensayo tiene dos objetivos primarios independientes: evaluar el efecto de vafidemstat sobre los síntomas negativos de la esquizofrenia, y evaluar la mejora del deterioro cognitivo asociado a la esquizofrenia.
21 de Septiembre de 2021 ORYZON anuncia una ayuda de 1 millón de dólares por parte de filántropos del Síndrome de Kabuki para apoyar un ensayo de Fase I/II de medicina de precisión con vafidemstat
Oryzon anunció una ayuda de un millón de dólares para apoyar un nuevo ensayo clínico con nuestro inhibidor de LSD1 en Fase II, vafidemstat, en pacientes con síndrome de Kabuki . La ayuda ha sido concedida por una familia de un paciente cuyos otros esfuerzos filantrópicos incluyen la fundación de la clínica Roya Kabuki en el Hospital Infantil de Boston y la participación en la junta de la Kabuki Syndrome Foundation (KSF).
13 de Octubre de 2021 ORYZON presenta datos de seguridad y eficacia de vafidemstat del ensayo de Fase II SATEEN en esclerosis múltiple en el congreso ECTRIMS-2021
Oryzon anunció la presentación de datos finales de la capacidad de vafidemstat para reducir la respuesta inflamatoria en pacientes con esclerosis múltiple (EM) del ensayo de Fase II SATEEN en el 37º Congreso del Comité Europeo para el Tratamiento e Investigación en Esclerosis Múltiple, ECTRIMS-2021, en una comunicación en formato póster electrónico titulada “Safety And Efficacy Data From SATEEN Trial In Multiple Sclerosis”.
18 de Octubre de 2021 ORYZON anuncia la inclusión del primer paciente en EE.UU. en PORTICO, un ensayo clínico de Fase IIb con vafidemstat en Trastorno Límite de Personalidad
Oryzon anunció la inclusión del primer paciente en Estados Unidos en su ensayo clínico de Fase IIb con vafidemstat, un inhibidor selectivo de la diana epigenética LSD1, en enfermos de Trastorno Límite de Personalidad (TLP).
Sobre Oryzon
Fundada en 2000 en Barcelona, España, Oryzon es una compañía biofarmacéutica de fase clínica líder europea en Epigenética. Oryzon tiene una de las carteras más fuertes en el sector. El programa LSD1 de Oryzon tiene en la actualidad dos moléculas en ensayos clínicos de Fase II, vafidemstat y iadademstat. Además, Oryzon cuenta con programas en curso para el desarrollo de inhibidores contra otras dianas epigenéticas. La compañía posee también una fuerte plataforma tecnológica para la identificación de biomarcadores y valida biomarcadores y dianas para una variedad de enfermedades oncológicas y neurológicas. La compañía tiene oficinas en España y EEUU. Para más información, visitar www.oryzon.com
Sobre Iadademstat
Iadademstat (ORY-1001) es una pequeña molécula oral, que actúa como inhibidor altamente selectivo de la enzima epigenética LSD1 y tiene un potente efecto diferenciador en cánceres hematológicos (ver Maes et al., Cancer Cell. 2018 Mar 12;33(3):495-511.e12. doi: 10.1016/j.ccell.2018.02.002.). Un primer estudio clínico de Fase I/IIa con iadademstat en pacientes de leucemia aguda recurrente o refractaria demostró la seguridad y buena tolerabilidad del fármaco y señales preliminares de actividad antileucémica, incluyendo una CRi. Más allá de los cánceres hematológicos, la inhibición de LSD1 se ha propuesto como una aproximación terapéutica válida en ciertos tumores sólidos como el cáncer de pulmón de células pequeñas (CPCP), tumores neuroendocrinos, meduloblastoma y otros. Iadademstat se ha probado en cuatro ensayos clínicos (dos en monoterapia en CPCP y LMA, y dos en combinación, en CPCP y LMA) en más de 100 pacientes. En los estudios de combinación, ALICE (en curso), un estudio de Fase IIa en combinación con azacitidina en pacientes con LMA de edad avanzada y CLEPSIDRA (finalizado), un estudio de Fase IIa en combinación con platino/etopósido en pacientes con CPCP de segunda línea, se han reportado resultados preliminares de eficacia.
Sobre Vafidemstat
Vafidemstat (ORY-2001) es una pequeña molécula oral, que actúa como inhibidor de LSD1 optimizado para SNC. La molécula actúa a diferentes niveles, reduciendo el deterioro cognitivo, la pérdida de memoria y la neuroinflamación, y además ejerce efectos neuroprotectores. En modelos preclínicos vafidemstat restaura el deterioro cognitivo y elimina la agresividad exacerbada de los ratones SAMP8, un modelo de envejecimiento acelerado y Enfermedad de Alzheimer (EA), a niveles normales y también reduce la evitación social e incrementa la sociabilidad en diferentes modelos murinos. Además, vafidemstat ha mostrado una eficacia rápida, potente y duradera en varios modelos preclínicos de esclerosis múltiple (EM). Oryzon ha llevado a cabo dos estudios clínicos de Fase IIa en agresividad en pacientes con diferentes enfermedades psiquiátricas (REIMAGINE) y en pacientes agitados/agresivos con EA moderado o severo (REIMAGINE-AD), con resultados clínicos positivos reportados en ambos. Otros estudios clínicos de Fase IIa con vafidemstat finalizados son el estudio ETHERAL en pacientes con EA leve o moderada, donde se ha demostrado una disminución significativa del biomarcador de inflamación YKL40 tras 6 y 12 meses de tratamiento, y el estudio piloto, de pequeña escala SATEEN en pacientes con EM remitente-recurrente y EM secundaria progresiva, donde también se ha observado actividad antiinflamatoria. Vafidemstat ha sido evaluado además en un ensayo de Fase II en pacientes graves por Covid-19 (ESCAPE) donde se evaluó la capacidad del fármaco de prevenir el Síndrome de Distrés Respiratorio Agudo, una de las complicaciones más graves de la infección viral, donde mostró efectos antiinflamatorios significativos en pacientes de Covid-19 graves. Actualmente vafidemstat está en dos ensayos clínico de Fase IIb en pacientes con trastorno límite de la personalidad (PORTICO) y en pacientes con esquizofrenia (EVOLUTION). Oryzon también está desplegando un enfoque de medicina de precisión en SNC con vafidemstat en subpoblaciones de pacientes definidas genéticamente de ciertas enfermedades del SNC.
AFIRMACIONES O DECLARACIONES CON PROYECCIONES DE FUTURO
Esta comunicación contiene información y afirmaciones o declaraciones con proyecciones de futuro sobre Oryzon. Asimismo, incluye proyecciones y estimaciones financieras con sus presunciones subyacentes, declaraciones relativas a planes, objetivos, y expectativas en relación con futuras operaciones, inversiones, sinergias, productos y servicios, y declaraciones sobre resultados futuros. Las declaraciones con proyecciones de futuro no constituyen hechos históricos y se identifican generalmente por el uso de términos como “espera”, “anticipa”, “cree”, “pretende”, “estima” y expresiones similares.
Si bien Oryzon considera que las expectativas recogidas en tales afirmaciones son razonables, se advierte a los inversores y accionistas de Oryzon de que la información y las afirmaciones con proyecciones de futuro están sometidas a riesgos e incertidumbres, muchos de los cuales son difíciles de prever y están, de manera general, fuera del control de Oryzon, lo que podría provocar que los resultados y desarrollos reales difieran significativamente de aquellos expresados, implícitos o proyectados en la información y afirmaciones con proyecciones de futuro. Entre tales riesgos e incertidumbres están aquellos identificados en los documentos remitidos por Oryzon a la Comisión Nacional del Mercado de Valores y que son accesibles al público.
Se recomienda no tomar decisiones sobre la base de afirmaciones o declaraciones con proyecciones de futuro, ya que se refieren exclusivamente a la fecha en la que se manifestaron, no constituyen garantía alguna de resultados futuros y no han sido revisadas por los auditores de Oryzon. La totalidad de las declaraciones o afirmaciones de futuro de forma oral o escrita emitidas por Oryzon o cualquiera de sus miembros del consejo, directivos, empleados o representantes quedan sujetas, expresamente, a las advertencias realizadas. Las afirmaciones o declaraciones con proyecciones de futuro incluidas en este documento están basadas en la información a disposición de Oryzon a la fecha de esta comunicación.