Oryzon anuncia sus resultados y avances en el primer trimestre de 2025
- Las inversiones en I+D ascienden a 2,4 M€
- El resultado neto de 1,7 M€ de pérdida acorde con el modelo de negocio con un periodo de maduración de sus productos a largo plazo
- Con fecha 25 de abril la Sociedad ha realizado una ampliación de capital de 30,0 M€ que fortalece su posición económica y financiera significativamente
- La Sociedad se encuentra a la espera de recibir en el segundo trimestre del 2025 el cobro de la subvención no reembolsable IPCEI (Med4Cure) por importe de 13,26 M€, lo que se trasladará en un avance significativo de sus inversiones en programas de desarrollo terapéutico
MADRID, ESPAÑA y CAMBRIDGE, EE.UU., 12 de mayo de 2025 – Oryzon Genomics S.A., compañía biofarmacéutica de fase clínica y líder europeo en epigenética, ha anunciado hoy sus resultados y avances en el primer trimestre de 2025.
El Dr. Carlos Buesa, CEO de Oryzon, ha declarado: “La compañía ha completado con éxito un aumento de capital de 30 M de euros estructurado como equity puro. A pesar de las condiciones de mercado muy adversas, la financiación atrajo una fuerte demanda y se amplió desde los 25 M de euros inicialmente previstos, terminando con una sobresuscripción significativa. Un inversor institucional de EE.UU. lideró la ronda con una orden de 15 M de euros. El aumento de capital fue limitado a 30 M de euros por el Consejo de Administración de la compañía.”
El Dr. Buesa ha continuado: “Estamos finalizando los preparativos para la próxima Fase III de vafidemstat para el tratamiento de la agitación y agresión en Trastorno Límite de la Personalidad (TLP). En colaboración con nuestro recientemente formado Comité Asesor Clínico, compuesto por destacados expertos en psiquiatría de EE.UU., hemos diseñado un protocolo de ensayo clínico de Fase III que creemos está alineado con las expectativas de la FDA. Como continuación de nuestro diálogo de Fin de Fase II (EoP2) con la FDA, hemos recibido solicitudes adicionales de información complementaria, las cuales estamos atendiendo actualmente. Esperamos presentar tanto el protocolo de PORTICO-2 como la información adicional a la FDA en el primer semestre de 2025”. “También hemos continuado con el reclutamiento de pacientes en nuestro ensayo en curso EVOLUTION en esquizofrenia en España. El estudio clínico observacional en síndrome de Phelan-McDermid (PMS), una forma de autismo, publicado en Frontiers in Psychiatry, es un primer paso hacia un enfoque de medicina personalizada para explorar la aplicabilidad de vafidemstat en trastornos psiquiátricos asociados a SHANK3, incluido el PMS, donde la agitación y la agresión son componentes clave de la enfermedad.”
El Dr. Buesa ha continuado, “En oncología, estamos encantados de que el ensayo que evalúa iadademstat en combinación con atezolizumab o durvalumab en cáncer de pulmón de célula pequeña (CPCP), bajo nuestro acuerdo CRADA y con el NCI como sponsor, haya comenzado a reclutar pacientes. La biología que sustenta la sinergia entre iadademstat y los inhibidores de puntos de control inmunitario (ICIs) es sumamente convincente. Análisis retrospectivos recientes de múltiples ensayos de Fase III con ICIs en CPCP han mostrado que los pacientes con niveles más bajos de expresión de LSD1 obtuvieron las mejores respuestas.”
El Dr. Buesa ha continuado: “También estamos muy entusiasmados con el ensayo iniciado por investigador (IIS por sus siglas en inglés) de iadademstat en combinación con azacitidina en síndrome mielodisplásico, una enfermedad con una importante necesidad médica no cubierta, liderado por el Medical College of Wisconsin. El ensayo ha seguido reclutando activamente pacientes durante este trimestre, completando la primera cohorte sin alertas de seguridad y con señales de eficacia alentadoras.”
El Dr. Buesa ha añadido: “Hemos asegurado 13,26 millones de euros a través de la subvención no reembolsable IPCEI Med4Cure de la UE. Combinado con la reciente ampliación de capital de 30 millones de euros, la empresa ha asegurado aproximadamente 50 millones de dólares, a pesar de las complejas condiciones del mercado. Estas dos financiaciones, junto con otras entradas adicionales, sitúan a la compañía en una sólida posición de caja para centrarse en la ejecución y avanzar nuestros programas de I+D en medicina personalizada para el SNC y oncología.”
EVOLUCIÓN DEL NEGOCIO
Primer trimestre y otros destacados recientes
Vafidemstat en grandes trastornos multifactoriales del SNC:
- Oryzon está finalizando los preparativos para la Fase III en TLP, incluyendo la preparación de un protocolo completo para el ensayo de Fase III PORTICO-2 que se presentará a la FDA para su aprobación. Los criterios de valoración primarios y secundarios clave para este ensayo se han definido en colaboración con el recién formado Comité Asesor Clínico (CAB) de Oryzon, compuesto por destacados expertos en investigación psiquiátrica y ensayos clínicos para trastornos psiquiátricos. El ensayo utilizará la escala STAXI-2 Trait Anger como criterio de valoración primario de eficacia, y como criterios de valoración secundarios incluirá tanto escalas valoradas por personal clínico como escalas valoradas por el paciente para evaluar la agitación/agresividad y la mejoría general del TLP. La compañía sigue con su plan de presentar el protocolo de PORTICO-2 para su aprobación a la FDA en el primer semestre de 2025. El tamaño total estimado de la muestra para PORTICO-2 será de 350 pacientes (randomizados 1:1 entre vafidemstat o control), con una duración total del ensayo de 18 semanas. Sujeto a la revisión por parte de la FDA de los datos finales que se obtengan, el estudio de Fase III PORTICO-2 puede ser uno de los dos ensayos registracionales requeridos por la FDA.
- Los resultados finales de un estudio clínico observacional dirigido a caracterizar psicométricamente a individuos con síndrome de Phelan-McDermid (PMS) portadores de deleciones o variantes patogénicas en SHANK3 han sido publicados en línea en la revista Frontiers in Psychiatry. Como se describe en la publicación, la agrupación jerárquica no supervisada de los datos psicométricos recogidos identificó tres grupos de pacientes, con diferentes puntuaciones de perfil cognitivo, de agresión y de comportamiento. El objetivo de este estudio fue recopilar datos que pudieran servir como base para un futuro ensayo clínico de psiquiatría de precisión con vafidemstat en PMS.
- Oryzon ha continuado reforzando su cartera de patentes para vafidemstat durante este trimestre, con comunicaciones adicionales de “Decisión de concesión” por parte de las oficinas de patentes de Europa y Japón para las solicitudes tituladas “Métodos para tratar el trastorno por déficit de atención e hiperactividad utilizando inhibidores de KDM1A como el compuesto vafidemstat” y “Métodos para tratar el trastorno del espectro autista”, respectivamente. Una vez concedidas, estas patentes no expirarán hasta al menos 2040, excluyendo posibles extensiones de patente. Estas patentes complementan la cartera de patentes de Oryzon para vafidemstat en SNC, que incluye dos familias adicionales de patentes: una cubre el tratamiento de la agresión y el retraimiento social, con patentes ya concedidas o aprobadas en Europa, Australia, Hong Kong, Corea, Malasia, Filipinas y Rusia, mientras que la segunda familia de patentes se refiere al tratamiento del trastorno límite de la personalidad, con patentes aprobadas o concedidas por ahora en Europa, Japón, México, Rusia, Singapur y Sudáfrica. Las patentes de estas dos familias permanecerán en vigor hasta al menos 2038 y 2040, respectivamente, excluyendo cualquier posible extensión de patente, que podrían proporcionar años adicionales de protección.
- El ensayo clínico de Fase IIb EVOLUTION con vafidemstat en pacientes con esquizofrenia ha continuado reclutando pacientes. Este estudio tiene como objetivo evaluar la eficacia de vafidemstat, centrado principalmente en la mejora de los síntomas negativos. Como objetivos secundarios el ensayo explora la eficacia de vafidemstat para mejorar el deterioro cognitivo y síntomas positivos de la esquizofrenia. Este proyecto está parcialmente financiado con fondos públicos del Ministerio de Ciencia e Innovación español y se lleva a cabo en diversos hospitales españoles.
Vafidemstat en trastornos monogénicos del SNC:
- Estamos evaluando la viabilidad de nuevos ensayos de medicina de precisión en trastornos autistas como el síndrome X frágil o el síndrome de Phelan-McDermid, entre otros. La compañía decidirá sobre una posible presentación de un IND para estos ensayos ante la EMA, la AEMPS o la FDA durante 2025.
Iadademstat en oncología:
- El ensayo de Fase I/II de iadademstat más inhibidores de puntos de control inmunitario (ICI) en pacientes con cáncer de pulmón de célula pequeña (CPCP) en estadio extenso en primera línea, bajo el Acuerdo de Cooperación en Investigación y Desarrollo (CRADA) que Oryzon tiene con el National Cancer Institute (NCI), comenzó a reclutar pacientes en abril de 2025. El ensayo, titulado “Ensayo de Fase I de búsqueda de dosis y de Fase II aleatorizado de iadademstat combinado con terapia de mantenimiento con inhibidores de puntos de control inmunitario tras quimioinmunoterapia inicial en pacientes con cáncer de pulmón de células pequeñas en estadio extenso”, evaluará la seguridad, tolerabilidad, determinación de dosis y eficacia de iadademstat en combinación con un ICI, ya sea atezolizumab o durvalumab, en pacientes con CPCP en estadio extenso que hayan recibido inicialmente quimioterapia estándar e inmunoterapia. Este estudio es llevado a cabo y esponsorizado por el NCI, con el Dr. Charles Rudin del Memorial Sloan Kettering Cancer Center (MSKCC) como investigador principal del ensayo. Más de 20 centros en EE.UU. participan en el ensayo, incluyendo instituciones de renombre como MSKCC, Johns Hopkins, City of Hope, University of Chicago, entre muchas otras. El ensayo planea reclutar entre 45 y 50 pacientes.
- Ha continuado el reclutamiento de pacientes en FRIDA, un ensayo clínico de Fase Ib en abierto, multicéntrico, de iadademstat en combinación con gilteritinib en pacientes con leucemia mieloide aguda (LMA) recidivante/refractaria (R/R) que albergan una mutación de la tirosina quinasa tipo FMS (FLT3mut+). Siguiendo la nueva doctrina OPTIMUS de la FDA, la compañía sigue explorando la dosis mínima con actividad clínica. Los objetivos primarios de FRIDA son evaluar la seguridad y tolerabilidad de iadademstat en combinación con gilteritinib en pacientes con LMA R/R con mutaciones FLT3 y establecer la dosis recomendada de Fase 2 (RP2D) para esta combinación, mientras que los objetivos secundarios incluyen la evaluación de la eficacia del tratamiento. El estudio se lleva a cabo en EE.UU. e incluirá hasta 45 pacientes aproximadamente. Si los resultados son favorables, la compañía y la FDA han acordado celebrar una reunión para discutir el mejor plan para seguir desarrollando esta combinación en esta población de LMA tan necesitada. La compañía planea presentar la próxima actualización de datos de este ensayo en ASH-2025.
- Los dos ensayos de Fase I de búsqueda de dosis de iadademstat en combinación con venetoclax y azacitidina en pacientes con LMA de primera línea, uno esponsorizado por el NCI bajo el acuerdo CRADA firmado entre Oryzon y el NCI, y el otro como ensayo de tipo “estudio iniciado por un investigador” (IIS, por sus siglas en inglés), liderado por el Knight Cancer Institute del Oregon Health & Science University (OHSU) de EE.UU., han continuado reclutando pacientes de forma activa.
- El estudio IIS de Fase I de búsqueda de dosis de iadademstat en combinación con azacitidina en síndrome mielodisplásico, estudio esponsorizado por el Medical College of Wisconsin, ha continuado reclutando pacientes de forma activa durante este trimestre y ha completado la primera cohorte.
Programas en fases más tempranas:
- ORY-4001, un inhibidor muy selectivo de la deacetilasa de histonas 6 (HDAC-6), nominado como candidato a desarrollo clínico para el tratamiento de ciertas enfermedades neurológicas como la enfermedad de Charcot Marie-Tooth (CMT), la esclerosis lateral amiotrófica (ELA) y otras, sigue avanzando en los estudios IND pre-regulatorios que permitirán preparar el compuesto para estudios clínicos.
Información financiera del primer trimestre de 2025
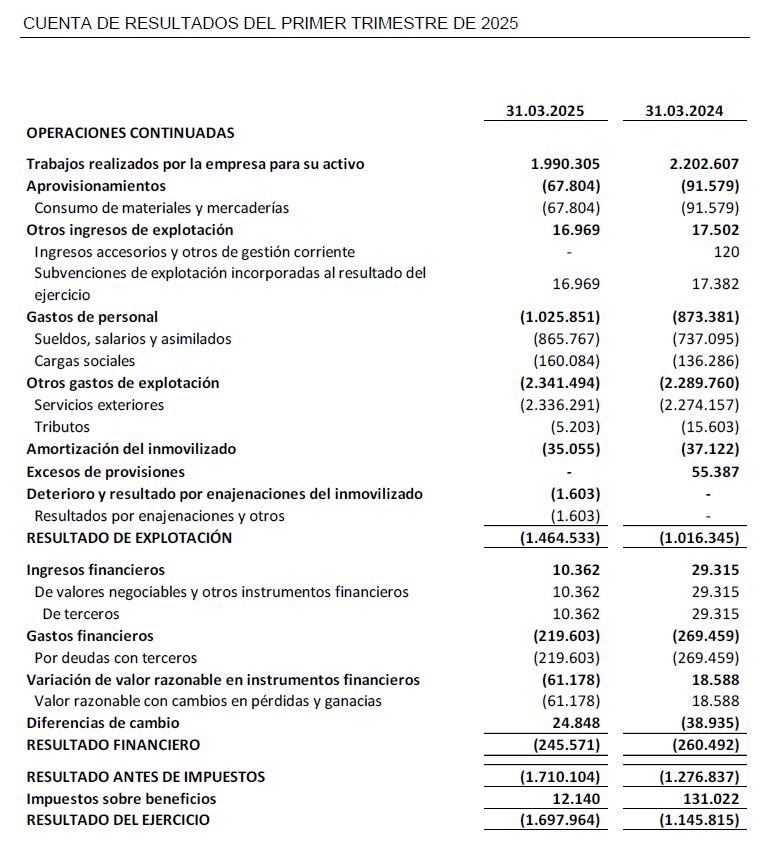
Las inversiones en I+D a 31 de marzo de 2025 han ascendido a 2,4 M€, de las cuales 2,1 M€ corresponden a actividades de desarrollo y 0,3 M€ a actividades de investigación.
El resultado neto al cierre del primer trimestre de 2025 se sitúa en -1,7 M€ frente al primer trimestre del ejercicio precedente de -1,1 M€.
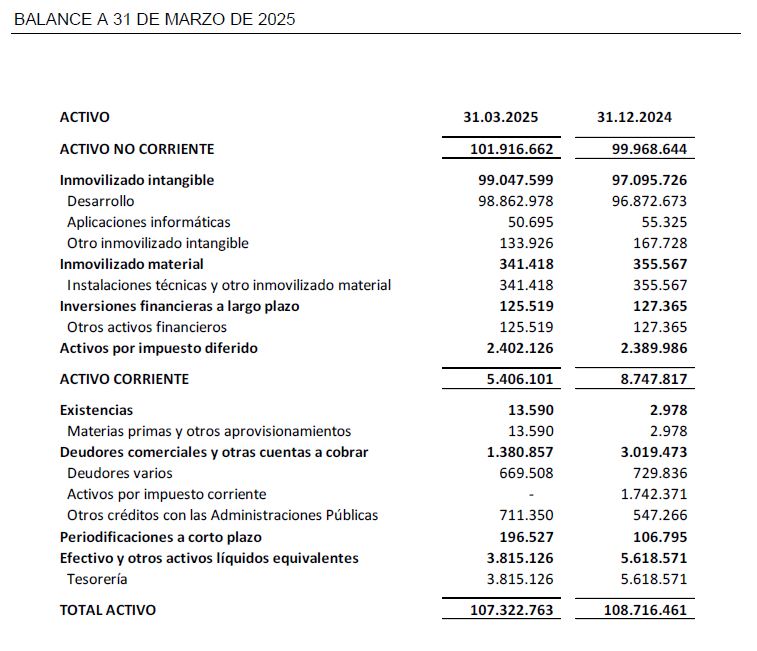
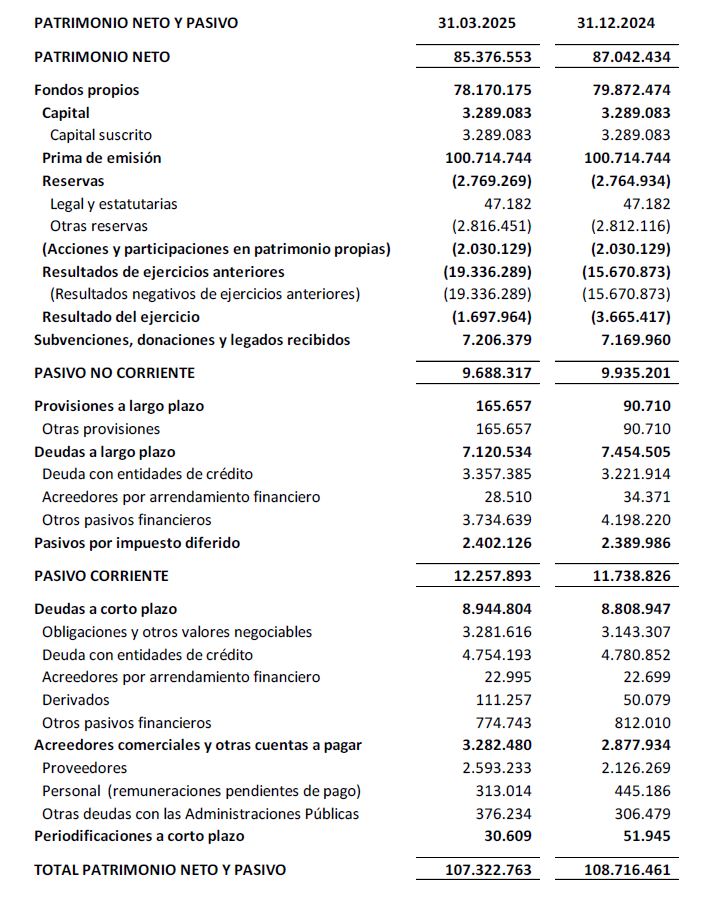
El balance a 31 marzo de 2025 presenta un patrimonio neto de 85,4 M€.
En el mes de abril la Sociedad ha captado 30 millones de euros en una ampliación de capital internacional con fuerte demanda inversora; la colocación fue significativamente sobresuscrita, fortalece la posición económica y financiera significativamente para permitir un diálogo estratégico con inversores y posibles socios corporativos.
Los fondos se destinarán principalmente a:
- Avanzar en el desarrollo clínico de vafidemstat para el tratamiento de la agresividad en trastornos del sistema nervioso central, como el trastorno límite de la personalidad (TLP) y el trastorno del espectro autista (TEA).
- Ampliar los programas clínicos en curso en oncología y hematología.
- Apoyar las actividades CMC y los preparativos para los ensayos de Fase IIb-III, así como otras iniciativas regulatorias.
- Reforzar el balance financiero de la compañía con vistas a futuras negociaciones de colaboración o fusiones/adquisiciones.
- Cubrir gastos generales, administrativos y obligaciones financieras.
- Potenciar la preparación legal y de auditoría de cara a una posible doble cotización en Nasdaq.
El 7 de mayo de 2025 se publicó la propuesta de resolución provisional correspondiente al Proyecto Importante de Interés común Europeo de Salud (IPCEI) Med4Cure, según el anexo I de la Decisión C(2024) 3629 final, establecido en el marco del Plan de Recuperación, Transformación y Resiliencia, que otorga a la Sociedad como participante asociado una subvención no reembolsable por importe de 13,26 M€ para su proyecto VANDAM. Esta cantidad corresponde al 64% del presupuesto total aceptado de 20,68 M€.
Sobre Oryzon
Fundada en 2000 en Barcelona, España, Oryzon es una compañía biofarmacéutica de fase clínica líder europea en epigenética, con un fuerte enfoque en medicina personalizada para enfermedades del SNC y oncología. El equipo de Oryzon se compone de profesionales altamente cualificados de la industria farmacéutica, ubicados en Barcelona, Boston y San Diego. Oryzon tiene una cartera clínica avanzada, con dos inhibidores de LSD1, vafidemstat en SNC (listo para Fase III) y iadademstat en oncología (Fase II). La compañía tiene además otros programas dirigidos contra otras dianas epigenéticas como HDAC6, donde ORY-4001 ha sido nombrado como candidato clínico para el tratamiento de ciertas enfermedades neurológicas como CMT y ELA. La compañía posee también una fuerte plataforma para la identificación de biomarcadores y validación de dianas para una variedad de enfermedades oncológicas y neurológicas. Para más información, visitar www.oryzon.com
Sobre Iadademstat
Iadademstat (ORY-1001) es una pequeña molécula oral, que actúa como inhibidor altamente selectivo de la enzima epigenética LSD1 y tiene un potente efecto diferenciador en cánceres hematológicos (ver Maes et al., Cancer Cell. 2018 Mar 12;33(3):495-511.e12. doi: 10.1016/j.ccell.2018.02.002.). Un primer ensayo clínico de Fase I/IIa con iadademstat en pacientes con LMA recurrente o refractaria demostró la seguridad y buena tolerabilidad del fármaco y señales preliminares de actividad antileucémica, incluyendo una CRi (ver Salamero et al, J Clin Oncol, 2020, 38(36): 4260-4273. doi: 10.1200/JCO.19.03250). Iadademstat ha mostrado resultados alentadores de seguridad y potente actividad clínica en combinación con azacitidina en un ensayo de Fase IIa en pacientes ancianos con LMA de primera línea (ensayo ALICE) (ver Salamero et al., comunicación oral ASH-2022 y The Lancet Haematology, 2024, 11(7):e487-e498). Iadademstat está siendo evaluado actualmente en combinación con gilteritinib en el ensayo de Fase Ib FRIDA en pacientes con LMA refractarios/en recaida con mutaciones FLT3, y en combinación con azacitidina y venetoclax en LMA en primera línea en un ensayo iniciado por investigador (IIS) esponsorizado por OHSU y en un ensayo bajo el Acuerdo de Cooperación en Investigación y Desarrollo (CRADA) firmado con el Instituto Nacional del Cáncer (NCI) de EEUU para colaborar en el desarrollo clínico adicional de iadademstat en diferentes tipos de cánceres sólidos y hematológicos. Más allá de los cánceres hematológicos, la inhibición de LSD1 se ha propuesto como una aproximación terapéutica válida en ciertos tumores sólidos como el cáncer de pulmón de células pequeñas (CPCP), tumores neuroendocrinos (NET), meduloblastoma y otros. En un estudio de Fase IIa en combinación con platino/etopósido en pacientes con CPCP de segunda línea (ensayo CLEPSIDRA), se han reportado resultados preliminares de actividad y seguridad (ver Navarro et al, póster ESMO-2018). Iadademstat está en un ensayo colaborativo de Fase II con el Fox Chase Cancer Center en combinación con paclitaxel en carcinomas neuroendocrinos refractarios/en recaida, y en un ensayo de Fase I/II aleatorizado en CPCP en primera línea en combinación con ICI esponsorizado por NCI y liderado por el Memorial Sloan Kettering Cancer Center. Oryzon está ampliando además el desarrollo clínico de iadademstat a través de estudios clínicos iniciados por investigador adicionales. Iadademstat tiene la designación de medicamento huérfano para CPCP en EEUU y para LMA en EEUU y la UE.
Sobre Vafidemstat
Vafidemstat (ORY-2001) es un inhibidor de LSD1 optimizado para SNC activo por vía oral. La molécula actúa a diferentes niveles, reduciendo el deterioro cognitivo, la pérdida de memoria y la neuroinflamación, y además ejerce efectos neuroprotectores. En modelos preclínicos vafidemstat restaura el deterioro cognitivo y elimina la agresividad exacerbada de los ratones SAMP8, un modelo de envejecimiento acelerado y Enfermedad de Alzheimer (EA), a niveles normales y también reduce la evitación social e incrementa la sociabilidad en diferentes modelos murinos. Además, vafidemstat ha mostrado una eficacia rápida, potente y duradera en varios modelos preclínicos de esclerosis múltiple (EM). Oryzon ha llevado a cabo dos estudios clínicos de Fase IIa en agresividad en pacientes con diferentes enfermedades psiquiátricas (REIMAGINE, ver Ferrer et al, Psychiatry & Clin Neurosci, 2025, doi.org/10.1111/pcn.13800) y en pacientes agitados/agresivos con EA moderado o severo (REIMAGINE-AD), con resultados clínicos positivos reportados en ambos. Otros estudios clínicos de Fase IIa con vafidemstat finalizados son el estudio ETHERAL en pacientes con EA leve o moderada, donde se demostró una disminución significativa del biomarcador de inflamación YKL40 tras 6 y 12 meses de tratamiento, y el estudio piloto, de pequeña escala SATEEN en pacientes con EM remitente-recurrente y EM secundaria progresiva, donde también se observó actividad antiinflamatoria. Vafidemstat ha sido evaluado además en un ensayo de Fase II en pacientes graves por Covid-19 (ESCAPE) donde se evaluó la capacidad del fármaco de prevenir el Síndrome de Distrés Respiratorio Agudo, una de las complicaciones más graves de la infección viral, donde mostró efectos antiinflamatorios significativos en pacientes de Covid-19 graves. Vafidemstat está avanzando actualmente como activo listo para Fase III en trastorno límite de la personalidad (TLP) tras la finalización del ensayo global, aleatorizado y doble ciego de Fase IIb PORTICO (datos finales presentados en ECNP-2024). Tras la recepción de la acta de la reunión de Fin de Fase II con la FDA para discutir los resultados de PORTICO, la empresa anunció sus planes para seguir adelante con un ensayo de Fase III, PORTICO-2, en agitación/agresión en TLP (presentación de protocolo a la FDA prevista para 1S2025). Vafidemstat está siendo investigado también en un ensayo de Fase IIb doble ciego, randomizado, controlado por placebo en síntomas negativos de la esquizofrenia (el ensayo EVOLUTION; reclutando pacientes). Oryzon también está desplegando un enfoque de medicina de precisión en SNC con vafidemstat en subpoblaciones de pacientes definidas genéticamente de ciertas enfermedades del SNC, así como en síndromes del neurodesarrollo, y está evaluando la viabilidad de realizar ensayos clínicos en trastornos autistas como el síndrome de X frágil y el síndrome de Phelan-McDermid.
AFIRMACIONES O DECLARACIONES CON PROYECCIONES DE FUTURO
Esta comunicación contiene información y afirmaciones o declaraciones con proyecciones de futuro sobre Oryzon. Asimismo, incluye proyecciones y estimaciones financieras con sus presunciones subyacentes, declaraciones relativas a planes, objetivos, y expectativas en relación con futuras operaciones, inversiones, sinergias, productos y servicios, y declaraciones sobre resultados futuros. Las declaraciones con proyecciones de futuro no constituyen hechos históricos y se identifican generalmente por el uso de términos como “espera”, “anticipa”, “cree”, “pretende”, “estima” y expresiones similares.
Si bien Oryzon considera que las expectativas recogidas en tales afirmaciones son razonables, se advierte a los inversores y accionistas de Oryzon de que la información y las afirmaciones con proyecciones de futuro están sometidas a riesgos e incertidumbres, muchos de los cuales son difíciles de prever y están, de manera general, fuera del control de Oryzon, lo que podría provocar que los resultados y desarrollos reales difieran significativamente de aquellos expresados, implícitos o proyectados en la información y afirmaciones con proyecciones de futuro. Entre tales riesgos e incertidumbres están aquellos identificados en los documentos remitidos por Oryzon a la Comisión Nacional del Mercado de Valores y que son accesibles al público.
Se recomienda no tomar decisiones sobre la base de afirmaciones o declaraciones con proyecciones de futuro, ya que se refieren exclusivamente a la fecha en la que se manifestaron, no constituyen garantía alguna de resultados futuros y no han sido revisadas por los auditores de Oryzon. La totalidad de las declaraciones o afirmaciones de futuro de forma oral o escrita emitidas por Oryzon o cualquiera de sus miembros del consejo, directivos, empleados o representantes quedan sujetas, expresamente, a las advertencias realizadas. Las afirmaciones o declaraciones con proyecciones de futuro incluidas en este documento están basadas en la información a disposición de Oryzon a la fecha de esta comunicación.