Oryzon anuncia sus resultados y avances en el primer trimestre de 2022
MADRID, ESPAÑA y CAMBRIDGE, EE.UU., 5 de mayo de 2022 – Oryzon Genomics, S.A., la compañía española que desarrolla terapias experimentales epigenéticas innovadoras anuncia sus resultados y avances en el primer trimestre de 2022
ORYZON INVIERTE 3,8 M€ EN I+D DURANTE EL PRIMER TRIMESTRE DE 2022
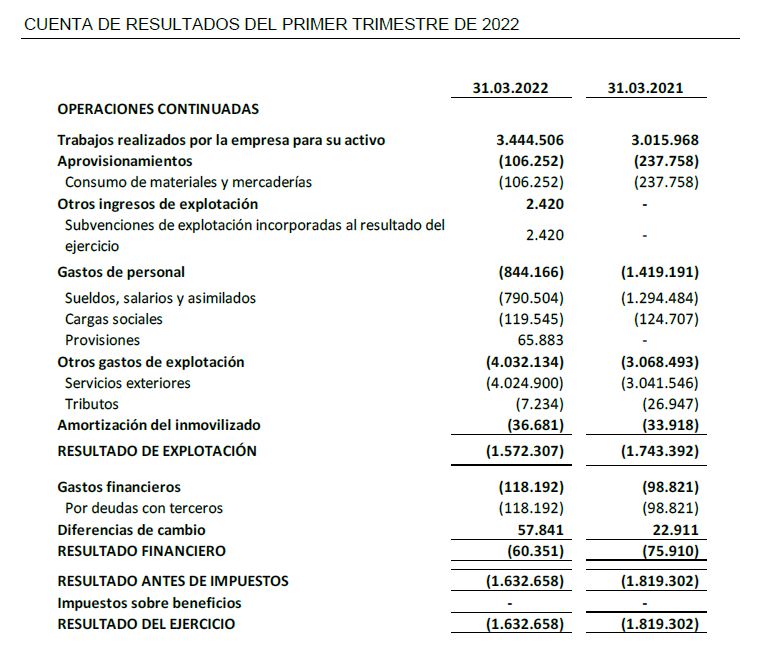
- Los ingresos relativos a trabajos realizados para el propio inmovilizado al cierre del primer trimestre de 2022 han ascendido a 3,4 M€.
- Inversiones en I+D de 3,8 M€, de las cuales 3,4 M€ corresponden a desarrollo y 0,4 M€ a investigación, aumentan 0,2 M€ con respecto al primer trimestre de 2021, lo que supone una variación de un +4%.
- El resultado neto de 1,6 M€ de pérdida se encuentra acorde con la especificidad del modelo de negocio de la biotecnología, en la fase de desarrollo en la que se halla la Sociedad, con un periodo de maduración de sus productos a largo plazo, y sin recurrencias desde la perspectiva de ingresos.
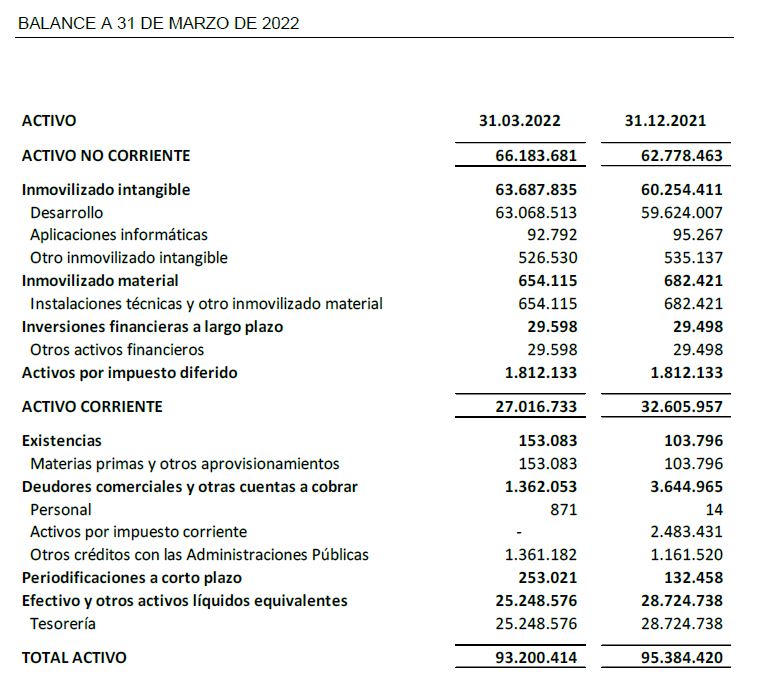
- Al cierre del primer trimestre el efectivo y las inversiones financieras disponibles ascienden a 25,2 M€.
EVOLUCIÓN DEL NEGOCIO
Primer trimestre y otros destacados recientes
La compañía ha continuado avanzando en este primer trimestre en el desarrollo clínico de sus programas de oncología iadademstat y neurología vafidemstat.
Iadademstat en oncología:
- Oryzon recibió la notificación de la FDA de EE.UU. de que su IND para iadademstat está aprobado para llevar a cabo FRIDA, un ensayo clínico de Fase Ib en pacientes con leucemia mieloide aguda (LMA) recidivante/refractaria (R/R) que albergan una mutación de la tirosina quinasa tipo FMS (FLT3mut+). FRIDA es un estudio abierto y multicéntrico de iadademstat más gilteritinib para el tratamiento de pacientes con LMA R/R con mutaciones FLT3. Los objetivos primarios son evaluar la seguridad y tolerabilidad de iadademstat en combinación con gilteritinib en pacientes con LMA R/R con mutaciones FLT3 y establecer la dosis recomendada de Fase 2 (RP2D) para esta combinación. Los objetivos secundarios incluyen la evaluación de la eficacia del tratamiento, medida como la tasa de remisión completa y remisión completa con recuperación hematológica parcial (CR/CRh), la duración de las respuestas (DoR) y la evaluación de la enfermedad residual medible. El estudio incluirá hasta 45 pacientes aproximadamente y, si los resultados son favorables, la compañía y la FDA han acordado celebrar una reunión para discutir el mejor plan para seguir desarrollando esta combinación en esta población de LMA tan necesitada.
- El ensayo de Fase II ALICE, que investiga iadademstat en combinación con azacitidina en leucemia mieloide aguda (LMA), ha completado el reclutamiento, con un total de 36 pacientes. Los resultados preliminares correspondientes a los 36 meses del estudio fueron presentados en el congreso ASH2021 el pasado mes de diciembre, mostrando señales robustas de eficacia clínica, con ORR del 78%, de los cuales el 62% eran CR/CRi, así como un un buen perfil de seguridad de la combinación de iadademstat y azacitidina. La duración de las respuestas observadas fue muy alentadora, con el 77% de las CR/CRi con duraciones de más de 6 meses. La remisión más larga en la fecha de corte de los datos para ASH-2021 era de más de 1.000 días, con el paciente independiente de transfusiones y negativo para la ERM. La compañía tiene previsto presentar una nueva actualización clínica sobre ALICE en el congreso EHA-2022 y los datos finales en ASH-2022.
- La compañía está preparando nuevos ensayos en combinación en tumores sólidos. En cáncer de pulmón de célula pequeña (CPCP), la compañía está preparando el ensayo STELLAR. STELLAR es un ensayo de Fase Ib/II aleatorizado y multicéntrico de iadademstat con un inhibidor de punto de control inmunitario (ICI) en pacientes con CPCP metastásico en primera línea. La compañía cree que STELLAR podría potencialmente apoyar una solicitud de aprobación de comercialización acelerada. Además, la compañía está preparando un ensayo de Fase Ib/II de iadademstat en combinación con agentes sinérgicos en CPCP R/R a platino y en tumores neuroendocrinos (NET) de alto grado extrapulmonares. Ambos ensayos se llevaran a cabo en EE.UU.
Vafidemstat en grandes trastornos multifactoriales del SNC:
- Tras recibir la aprobación para el brazo serbio del ensayo clínico de Fase IIb PORTICO con vafidemstat en pacientes con Trastorno Límite de la Personalidad (TLP), se ha completado la fase de despliegue de PORTICO. El estudio está actualmente reclutando pacientes de forma activa en Europa y EE.UU. PORTICO es un estudio de Fase IIb multicéntrico, doble ciego, aleatorizado y controlado con placebo para evaluar la eficacia y seguridad de vafidemstat en pacientes con TLP. El ensayo tiene dos objetivos primarios independientes: la reducción de la agresividad/agitación y la mejora global de la enfermedad. El estudio incluirá 156 pacientes, con 78 pacientes en cada brazo, y cuenta con un análisis intermedio predefinido para ajustar el tamaño de la muestra en caso de una variabilidad excesiva en torno a las variables de evaluación o una tasa de placebo inesperadamente alta. El ensayo se llevará a cabo en 15-20 centros en Europa y Estados Unidos.
- El ensayo clínico de Fase IIb EVOLUTION con vafidemstat en pacientes con esquizofrenia ha continuado reclutando pacientes. Este estudio de Fase IIb evaluará la eficacia de vafidemstat sobre los síntomas negativos y la cognición en pacientes con esquizofrenia. Este proyecto está parcialmente financiado con fondos públicos del Ministerio de Ciencia e Innovación y se realizará en diversos hospitales españoles.
Vafidemstat en trastornos monogénicos del SNC:
- La compañía está finalizando la preparación de un nuevo ensayo de medicina de precisión en pacientes con síndrome de Kabuki (SK). Este ensayo de Fase I/II, denominado HOPE, será un ensayo multicéntrico, multibrazo, aleatorizado, doble ciego y controlado con placebo para explorar la seguridad y la eficacia de vafidemstat en la mejora de varias deficiencias descritas en pacientes con SK. El ensayo prevé reclutar a 50-60 pacientes y se realizará en niños mayores de 12 años y en adultos jóvenes. La compañía espera iniciar HOPE en la primera mitad de 2022 en varios hospitales y centros de EE.UU y, posiblemente, en Europa. Teniendo en cuenta los precedentes de la FDA y la EMA en enfermedades raras y trastornos del SNC, creemos que si el ensayo HOPE demuestra mejoras clínicas relevantes, podría servir de base para una aprobación acelerada en la UE y en Estados Unidos.
- Nuestros programas en medicina de precisión en enfermedad psiquiátrica continúan avanzando. Tenemos colaboraciones en autismo con investigadores del Centro Seaver de Investigación y Tratamiento del Autismo en la Facultad de Medicina Icahn en el Hospital Mount Sinai de Nueva York y con el Instituto de Genética Médica y Molecular (INGEMM) del Hospital Universitario La Paz de Madrid, y en esquizofrenia con investigadores de la Universidad de Columbia en Nueva York. Los resultados de los estudios piloto en marcha de caracterización de pacientes con mutaciones especificas, que servirán para informar posteriores estudios clínicos de psiquiatría de precisión con vafidemstat, se esperan que concluyan en 2022.
Información financiera del primer trimestre de 2022
El resultado neto al cierre del primer trimestre de 2022 se sitúa -1,6 M€ frente al primer trimestre del ejercicio precedente de -1,8 M€, lo que representa una mejora del 10%.
A 31 de marzo de 2022, Oryzon mantiene una posición financiera con recursos disponibles por importe de 25,2 M€, que le permite continuar con el desarrollo de sus actividades de I+D y el desarrollo de sus estudios clínicos.
Oryzon ha intensificado sus Inversiones en I+D en el primer trimestre de 2022 hasta alcanzar una cifra de 3,8 M€, lo que supone una variación de un +4% respecto al mismo periodo del ejercicio precedente. Las inversiones en I+D de 3,8 M€ corresponden a 3,4 M€ a actividades de desarrollo y a 0,4 M€ a actividades de investigación.
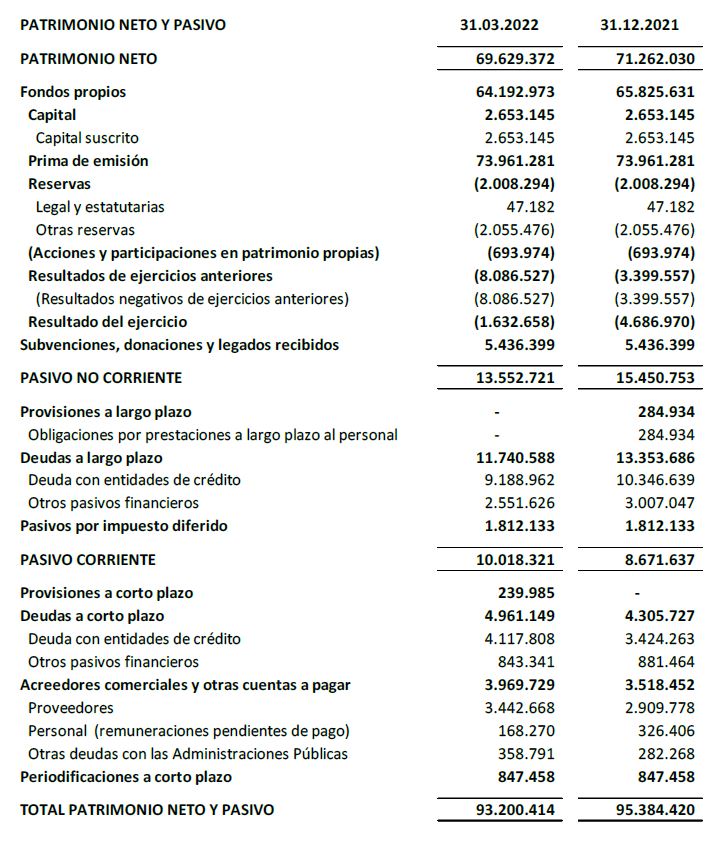
El balance a 31 de marzo de 2022 presenta un patrimonio neto de 69,6 M€.
Sobre Oryzon
Fundada en 2000 en Barcelona, España, Oryzon es una compañía biofarmacéutica de fase clínica líder europea en epigenética. Oryzon tiene una de las carteras más fuertes en el sector, con dos inhibidores de LSD1 en ensayos clínicos de Fase II, iadademstat y vafidemstat, y otros programas dirigidos contra otras dianas epigenéticas. La compañía posee también una fuerte plataforma para la identificación de biomarcadores y validación de dianas para una variedad de enfermedades oncológicas y neurológicas. Para más información, visitar www.oryzon.com
Sobre Iadademstat
Iadademstat (ORY-1001) es una pequeña molécula oral, que actúa como inhibidor altamente selectivo de la enzima epigenética LSD1 y tiene un potente efecto diferenciador en cánceres hematológicos (ver Maes et al., Cancer Cell. 2018 Mar 12;33(3):495-511.e12. doi: 10.1016/j.ccell.2018.02.002.). Un primer ensayo clínico de Fase I/IIa con iadademstat en pacientes con LMA recurrente o refractaria demostró la seguridad y buena tolerabilidad del fármaco y señales preliminares de actividad antileucémica, incluyendo una CRi (ver Salamero et al, J Clin Oncol, 2020, 38(36): 4260-4273. doi: 10.1200/JCO.19.03250). En un ensayo de Fase IIa aún en curso en pacientes ancianos con LMA de primera línea (ensayo ALICE), iadademstat ha mostrado resultados alentadores de seguridad y eficacia en combinación con azacitidina. La compañía ha obtenido recientemente la aprobación de la FDA de EE.UU para su IND para FRIDA, un ensayo de Fase Ib de iadademstat más gilteritinib en pacientes con LMA recidivante/refractaria con mutaciones FLT3. Más allá de los cánceres hematológicos, la inhibición de LSD1 se ha propuesto como una aproximación terapéutica válida en ciertos tumores sólidos como el cáncer de pulmón de células pequeñas (CPCP), tumores neuroendocrinos (NET), meduloblastoma y otros. En un estudio de Fase IIa en combinación con platino/etopósido en pacientes con CPCP de segunda línea (ensayo CLEPSIDRA, ya finalizado), se han reportado resultados preliminares de eficacia. La compañía está preparando nuevos ensayos en combinación en CPCP y NET. En total iadademstat ha sido probado en 4 ensayos clínicos en más de 100 pacientes.
Sobre Vafidemstat
Vafidemstat (ORY-2001) es un inhibidor de LSD1 optimizado para SNC activo por vía oral. La molécula actúa a diferentes niveles, reduciendo el deterioro cognitivo, la pérdida de memoria y la neuroinflamación, y además ejerce efectos neuroprotectores. En modelos preclínicos vafidemstat restaura el deterioro cognitivo y elimina la agresividad exacerbada de los ratones SAMP8, un modelo de envejecimiento acelerado y Enfermedad de Alzheimer (EA), a niveles normales y también reduce la evitación social e incrementa la sociabilidad en diferentes modelos murinos. Además, vafidemstat ha mostrado una eficacia rápida, potente y duradera en varios modelos preclínicos de esclerosis múltiple (EM). Oryzon ha llevado a cabo dos estudios clínicos de Fase IIa en agresividad en pacientes con diferentes enfermedades psiquiátricas (REIMAGINE) y en pacientes agitados/agresivos con EA moderado o severo (REIMAGINE-AD), con resultados clínicos positivos reportados en ambos. Otros estudios clínicos de Fase IIa con vafidemstat finalizados son el estudio ETHERAL en pacientes con EA leve o moderada, donde se ha demostrado una disminución significativa del biomarcador de inflamación YKL40 tras 6 y 12 meses de tratamiento, y el estudio piloto, de pequeña escala SATEEN en pacientes con EM remitente-recurrente y EM secundaria progresiva, donde también se ha observado actividad antiinflamatoria. Vafidemstat ha sido evaluado además en un ensayo de Fase II en pacientes graves por Covid-19 (ESCAPE) donde se evaluó la capacidad del fármaco de prevenir el Síndrome de Distrés Respiratorio Agudo, una de las complicaciones más graves de la infección viral, donde mostró efectos antiinflamatorios significativos en pacientes de Covid-19 graves. Actualmente vafidemstat está en dos ensayos clínico de Fase IIb en pacientes con trastorno límite de la personalidad (PORTICO) y en pacientes con esquizofrenia (EVOLUTION). Oryzon también está desplegando un enfoque de medicina de precisión en SNC y está preparando un unsayo clínico con vafidemstat en pacientes con síndrome de Kabuki, entre otras subpoblaciones de pacientes definidas genéticamente de ciertas enfermedades del SNC.
AFIRMACIONES O DECLARACIONES CON PROYECCIONES DE FUTURO
Esta comunicación contiene información y afirmaciones o declaraciones con proyecciones de futuro sobre Oryzon. Asimismo, incluye proyecciones y estimaciones financieras con sus presunciones subyacentes, declaraciones relativas a planes, objetivos, y expectativas en relación con futuras operaciones, inversiones, sinergias, productos y servicios, y declaraciones sobre resultados futuros. Las declaraciones con proyecciones de futuro no constituyen hechos históricos y se identifican generalmente por el uso de términos como “espera”, “anticipa”, “cree”, “pretende”, “estima” y expresiones similares.
Si bien Oryzon considera que las expectativas recogidas en tales afirmaciones son razonables, se advierte a los inversores y accionistas de Oryzon de que la información y las afirmaciones con proyecciones de futuro están sometidas a riesgos e incertidumbres, muchos de los cuales son difíciles de prever y están, de manera general, fuera del control de Oryzon, lo que podría provocar que los resultados y desarrollos reales difieran significativamente de aquellos expresados, implícitos o proyectados en la información y afirmaciones con proyecciones de futuro. Entre tales riesgos e incertidumbres están aquellos identificados en los documentos remitidos por Oryzon a la Comisión Nacional del Mercado de Valores y que son accesibles al público.
Se recomienda no tomar decisiones sobre la base de afirmaciones o declaraciones con proyecciones de futuro, ya que se refieren exclusivamente a la fecha en la que se manifestaron, no constituyen garantía alguna de resultados futuros y no han sido revisadas por los auditores de Oryzon. La totalidad de las declaraciones o afirmaciones de futuro de forma oral o escrita emitidas por Oryzon o cualquiera de sus miembros del consejo, directivos, empleados o representantes quedan sujetas, expresamente, a las advertencias realizadas. Las afirmaciones o declaraciones con proyecciones de futuro incluidas en este documento están basadas en la información a disposición de Oryzon a la fecha de esta comunicación.