ORYZON anuncia sus resultados y avances en el primer semestre de 2025
- Entre diciembre de 2024 y julio de 2025 Oryzon ha obtenido financiación por un importe de 52,0 M€, de los cuales 30,0 M€ proceden de una ampliación de capital, 7,0 M€ del apoyo de la banca comercial en una ronda de acompañamiento a la ampliación de capital, 13,2 M€ de la subvención IPCEI y 1,8 M€ de cash back de sus actividades de I+D.
- La posición de caja al cierre del primer semestre se sitúa en 31,1 M€, que se ve incrementada en el mes de julio con una entrada de caja de 13,2 M€ adicionales al haberse recibido el cobro de la subvención IPCEI (Med4Cure) procedente del CDTI.
- El resultado neto de 1,6 M€ de pérdidas no recoge los impactos de la resolución definitiva del IPCEI, recibida el 9 de julio de 2025; de haberse recibido dicha resolución a 30 de junio su impacto se hubiese trasladado en un reconocimiento de beneficios de 1,4 M€, situando el resultado del primer semestre en una pérdida de 0,2 M€. El reconocimiento de dichos beneficios se recogerá en los resultados del tercer trimestre de 2025.
- Dadas las actuales necesidades de tesorería de la Sociedad, se ha procedido en el mes de julio a la resolución del acuerdo de financiación entre Nice & Green y la Sociedad mediante un pago de 4,7 M€, recibiendo Oryzon 1.340.083 acciones propias, lo que incrementa la autocartera de Oryzon hasta 2.374.666 acciones.
MADRID, ESPAÑA y CAMBRIDGE, EE.UU., 30 de julio de 2025 – Oryzon Genomics S.A., compañía biofarmacéutica de fase clínica y líder europeo en epigenética, ha anunciado hoy sus resultados y avances en el primer semestre de 2025.
La compañía ha consolidado el proceso de financiación iniciado en diciembre de 2024 y finalizado en julio de 2025. Oryzon ha obtenido entre diciembre de 2024 y julio de 2025 financiación por un importe de 52,0 M€, de los cuales 30,0 M€ proceden de una ampliación de capital, 7,0 M€ del apoyo de la banca comercial en una ronda de acompañamiento a la ampliación de capital, 13,2 M€ de la subvención IPCEI y 1,8 M€ de cash back de sus actividades de I+D.
La compañía cerró con éxito en el mes de abril una ampliación de capital por valor de 30 M€ mediante una emisión directa de acciones ordinarias, sin emisión de warrants asociada. A pesar de las adversas condiciones del mercado, la operación despertó un fuerte interés entre los inversores, resultando en una sobresuscripción significativa.
El Dr. Carlos Buesa, CEO de Oryzon, ha declarado: “Nuestra exitosa ampliación de capital de 30 millones de euros, llevada a cabo en un contexto de condiciones de mercado extraordinariamente complicadas, representa un sólido voto de confianza en la ciencia de Oryzon, nuestro pipeline clínico y nuestra propuesta de valor a largo plazo. Los fondos obtenidos no solo refuerzan nuestra posición financiera, sino que también incrementan nuestra visibilidad en el panorama biotech internacional. Esta financiación nos permite impulsar nuestros programas clínicos con un renovado impulso y claridad estratégica. Confiamos en que los avances clínicos y los datos que presentaremos en los próximos trimestres seguirán validando la confianza que la comunidad inversora ha depositado en nosotros.”
El Dr. Buesa ha continuado: “Estamos cada vez más cerca de convertirnos en una compañía en Fase III, tras la presentación en junio ante la FDA del protocolo de ensayo clínico de Fase III de vafidemstat para el tratamiento de la agitación y la agresividad en el Trastorno Límite de la Personalidad (TLP). Este protocolo incorpora todas las observaciones y recomendaciones recibidas de la agencia en relación con los criterios de valoración. En paralelo, datos exploratorios adicionales procedentes de estudios previos de Fase IIa sugieren que vafidemstat también podría reducir la agresividad en otras poblaciones de pacientes. Sobre esta base, hemos iniciado los preparativos para un nuevo ensayo clínico de Fase II con el objetivo de evaluar vafidemstat en la agresividad asociada al trastorno del espectro autista, que estará parcialmente financiado a través de la ayuda recientemente concedida en el marco del programa europeo EU-IPCEI. Tras la reciente ampliación de capital, también estamos ampliando el ensayo clínico en curso EVOLUTION en esquizofrenia, hasta ahora realizado exclusivamente en España, a otros países europeos. Esta expansión geográfica está diseñada para acelerar el reclutamiento y reforzar aún más la solidez del ensayo.”
El Dr. Buesa ha continuado, “En oncología, estamos satisfechos con el sólido progreso que están experimentando todos los ensayos clínicos en curso con iadademstat. Esto incluye el ensayo FRIDA, esponsorizado por la compañía, en pacientes con LMA con mutación FLT3 en recaída o refractaria, así como los estudios iniciados por investigador (IIS) y CRADA en LMA en primera línea, en síndrome mielodisplásico y cáncer de pulmón de célula pequeña. Esperamos poder presentar actualizaciones y datos de algunos de estos programas en el próximo congreso ASH2025, que se celebrará este diciembre, lo que representará una buena oportunidad para compartir nuestros avances clínicos con la comunidad hematológica y oncológica internacional.”
El Dr. Buesa ha continuado: “Estamos muy entusiasmados de ampliar la evaluación clínica de iadademstat a indicaciones hematológicas no malignas, comenzando por la anemia falciforme. En esta patología, la inhibición de LSD1 desempeña un papel mecanístico central en la reinducción de la hemoglobina fetal, necesaria para revertir el fenotipo de la enfermedad. Nuestros datos preliminares en modelos de primates no humanos han sido muy alentadores en comparación con otros compuestos actualmente en desarrollo.” “El mercado de la anemia falciforme es considerable, como puso de manifiesto la experiencia de Pfizer con voxelotor (Oxbryta®), que recibió la aprobación acelerada de la FDA en 2019. Aunque el fármaco fue retirado en 2024 debido a aspectos de seguridad, su promesa comercial inicial puso de relieve tanto la importante necesidad médica no cubierta como el potencial de mercado asociado a esta indicación”, ha añadido.
EVOLUCIÓN DEL NEGOCIO
Primer semestre y otros destacados recientes
Vafidemstat:
- El protocolo del ensayo clínico de Fase III PORTICO-2 con vafidemstat en Trastorno Límite de la Personalidad (TLP) fue presentado en junio a la Food & Drug Administration de EE.UU. (FDA) para su aprobación. Los criterios de valoración primario y secundarios clave del ensayo han sido definidos en colaboración con el Comité Asesor Clínico (CAC) de Oryzon, compuesto por destacados expertos en investigación psiquiátrica y ensayos clínicos. PORTICO-2 empleará dos escalas clínicas para evaluar la agresividad: la escala STAXI-2 Trait Anger (una escala evaluada por el paciente) como criterio de valoración primario, y la escala Overt Aggression Scale-Modified (OAS-M) (evaluada por personal clínico) como criterio secundario clave. Otros criterios de valoración secundarios evaluarán la mejora general del TLP y la calidad de vida. El estudio incluirá aproximadamente 350 pacientes, distribuidos aleatoriamente en una proporción 1:1 para recibir vafidemstat o placebo, con una duración total del ensayo de 18 semanas. Sujeto a la revisión de los datos finales que se obtengan por parte de la FDA, PORTICO-2 podría ser uno de los dos ensayos registracionales requeridos por la FDA para la posible aprobación de vafidemstat en esta indicación. Se espera la aprobación del estudio por parte de la FDA en el segundo semestre de 2025.
- El pasado 9 de julio se celebró un seminario web específico con líderes de opinión (KOL), en el que participaron el Dr. Michael Ropacki, Director Médico de Oryzon para el área de SNC, y miembros del Comité Asesor Clínico (CAC) de la compañía. Durante el encuentro se abordaron el diseño del estudio PORTICO-2, la importante necesidad médica no cubierta en TLP, y el papel de la agresividad como diana clínica. Una grabación del evento está disponible en la página web de la compañía en el siguiente link: https://www.oryzon.com/es/noticias-eventos/eventos/evento-virtual-con-lideres-de-opinion-para-discutir-la-urgente-necesidad
- Oryzon ha anunciado planes para evaluar vafidemstat en el tratamiento de la agresividad en pacientes con trastorno del espectro autista (TEA) en un nuevo ensayo clínico de Fase II. Este ensayo, denominado HOPE-2, tiene previsto incluir, entre otras, subpoblaciones genéticamente definidas dentro del TEA, como personas con síndrome de Phelan-McDermid, y se llevará a cabo inicialmente en España en el marco de las actividades respaldadas por la iniciativa europea Med4Cure IPCEI recientemente concedida.
- El ensayo clínico de Fase IIb EVOLUTION con vafidemstat en pacientes con esquizofrenia ha continuado reclutando pacientes. Este estudio tiene como objetivo evaluar la eficacia de vafidemstat, centrado principalmente en la mejora de los síntomas negativos. Como objetivos secundarios el ensayo explorará la eficacia de vafidemstat para mejorar el deterioro cognitivo y síntomas positivos de la esquizofrenia. A partir de información obtenida en el ensayo PORTICO, se ha llevado a cabo una reevaluación del número de pacientes necesarios para alcanzar un impacto clínicamente significativo. Como resultado, el ensayo se está redimensionando para incluir un total de 84 pacientes. Inicialmente realizado únicamente en España, el estudio se está ampliando ahora para incluir también otros países de la Unión Europea.
- Oryzon ha continuado reforzando su cartera de patentes para vafidemstat durante este trimestre, con comunicaciones adicionales de “Decisión de concesión” por parte de las oficinas de patentes de Canadá e Israel para solicitudes de patente tituladas “Métodos para tratar alteraciones del comportamiento”. Las reivindicaciones aprobadas cubren el uso de vafidemstat para el tratamiento de la agresividad y el retraimiento social. Una vez concedidas, estas patentes permanecerán en vigor hasta al menos 2038, excluyendo cualquier posible extensión de patente. Ya se han concedido o aprobado patentes correspondientes en Europa, Australia, Hong Kong, Corea, Malasia, Filipinas y Rusia, y hay solicitudes en trámite en otros países.
Iadademstat:
- Ha continuado el reclutamiento de pacientes en FRIDA, un ensayo clínico de Fase Ib en abierto, multicéntrico, de iadademstat en combinación con gilteritinib en pacientes con leucemia mieloide aguda (LMA) recidivante/refractaria (R/R) que albergan una mutación de la tirosina quinasa tipo FMS (FLT3mut+). Siguiendo la nueva doctrina OPTIMUS de la FDA, la compañía sigue explorando la dosis mínima con actividad clínica. Los objetivos primarios de FRIDA son evaluar la seguridad y tolerabilidad de iadademstat en combinación con gilteritinib en pacientes con LMA R/R con mutaciones FLT3 y establecer la dosis recomendada de Fase 2 (RP2D) para esta combinación, mientras que los objetivos secundarios incluyen la evaluación de la eficacia del tratamiento. El estudio se lleva a cabo en EE.UU. e incluirá hasta 45 pacientes aproximadamente. Si los resultados son favorables, la compañía y la FDA han acordado celebrar una reunión para discutir el mejor plan para seguir desarrollando esta combinación en esta población de LMA tan necesitada. La compañía planea presentar la próxima actualización de datos de este ensayo en ASH-2025.
- Los dos ensayos de Fase I de búsqueda de dosis de iadademstat en combinación con venetoclax y azacitidina en pacientes con LMA de primera línea han continuado reclutando pacientes de forma activa. Uno de los ensayos está esponsorizado por el National Cancer Institute (NCI) bajo el acuerdo Acuerdo de Cooperación en Investigación y Desarrollo (CRADA) firmado entre Oryzon y el NCI, mientras que el otro es un ensayo de tipo “estudio iniciado por un investigador” (IIS, por sus siglas en inglés), liderado por el Knight Cancer Institute del Oregon Health & Science University (OHSU) de EE.UU.
- El estudio IIS de Fase I de búsqueda de dosis de iadademstat en combinación con azacitidina en síndrome mielodisplásico, estudio esponsorizado por el Medical College of Wisconsin, ha continuado reclutando pacientes de forma activa.
- El ensayo de Fase I/II de iadademstat más inhibidores de puntos de control inmunitario (ICI) en pacientes con cáncer de pulmón de célula pequeña (CPCP) en estadio extenso en primera línea, bajo el CRADA que Oryzon tiene con el NCI, comenzó a reclutar pacientes en abril de 2025. El ensayo evaluará la seguridad, tolerabilidad, determinación de dosis y eficacia de iadademstat en combinación con un ICI, ya sea atezolizumab o durvalumab, en pacientes con CPCP en estadio extenso que hayan recibido inicialmente quimioterapia estándar e inmunoterapia. Este estudio es llevado a cabo y esponsorizado por el NCI, con el Dr. Charles Rudin del Memorial Sloan Kettering Cancer Center (MSKCC) como investigador principal del ensayo. Más de 30 centros en EE.UU. participan en el ensayo, incluyendo instituciones de renombre como MSKCC, Johns Hopkins, City of Hope, University of Chicago, entre muchas otras. El ensayo planea reclutar entre 45 y 50 pacientes.
- Más allá de la oncología, Oryzon ha anunciado planes para evaluar iadademstat en trastornos hematológicos no malignos, como la anemia de células falciformes y la trombocitemia esencial. Se ha presentado una solicitud de ensayo clínico (CTA, por sus siglas en inglés), equivalente europeo a un IND, para un nuevo ensayo de Fase Ib con iadademstat en pacientes con anemia falciforme ante la Agencia Europea de Medicamentos (EMA). Este ensayo, denominado RESTORE, tiene como objetivo reclutar a 40 pacientes. Los objetivos primarios serán evaluar la seguridad y la tolerabilidad de iadademstat en pacientes adultos con anemia falciforme, así como determinar su dosis recomendada para la Fase 2 (RP2D). Entre los objetivos secundarios se incluye la evaluación de la actividad de iadademstat para inducir la producción de hemoglobina fetal, entre otros. Se espera obtenerla aprobación del CTA en septiembre. Un segundo ensayo, que evaluará iadademstat en pacientes con trombocitemia esencial, se encuentra actualmente en preparación, y la presentación del CTA ante la EMA está prevista para el segundo semestre de 2025.
Programas en fases más tempranas:
- ORY-4001, un inhibidor muy selectivo de la deacetilasa de histonas 6 (HDAC-6), nominado como candidato a desarrollo clínico para el tratamiento de ciertas enfermedades neurológicas como la enfermedad de Charcot Marie-Tooth (CMT), la esclerosis lateral amiotrófica (ELA) y otras, sigue avanzando en los estudios IND pre-regulatorios que permitirán preparar el compuesto para estudios clínicos.
Información financiera del primer semestre de 2025
Las inversiones en I+D en el primer semestre han ascendido a 4,9 M€, de las cuales 4,4 M€ corresponden a actividades de desarrollo y 0,5 M€ a actividades de investigación.
El resultado neto al cierre del primer semestre de 2025 se sitúa en -1,6 M€ frente al primer semestre del ejercicio precedente de -1,0 M€. Dicho resultado no recoge los impactos de la resolución definitiva del IPCEI (con respecto a las actividades llevadas a cabo en el periodo comprendido entre el 1 de enero del año 2023 y el 30 de junio de 2025), al haberse recibido dicha resolución con fecha 9 de julio de 2025. De haberse recibido dicha resolución a 30 de junio, su impacto se hubiese trasladado en un reconocimiento de beneficios de 1,4 M€, situado el resultado del primer semestre en una pérdida de 0,2 M€. El reconocimiento de dichos beneficios se recogerá en los resultados del tercer trimestre de 2025.
La posición de caja al cierre del primer semestre se sitúa en 31,1 M€, que se ve incrementada en el mes de julio con una entrada de caja de 13,2 M€ adicionales al haberse recibido el cobro de la subvención IPCEI (Med4Cure) procedente del CDTI.
Entre diciembre de 2024 y julio de 2025, Oryzon ha obtenido financiación por un importe de 52,0 M€, de los cuales 30,0 M€ proceden de una ampliación de capital, 7,0 M€ del apoyo de la banca comercial en una ronda de acompañamiento a la ampliación de capital, 13,2 M€ de la subvención IPCEI y 1,8 M€ de cash back de sus actividades de I+D. Dadas las actuales necesidades de tesorería de la Sociedad, atendiendo a las facultades conferidas al Consejo de Administración en reunión extraordinaria de la Junta General de Accionistas de fecha 28 de febrero de 2025, se ha procedido mediante un pago de 4,7 M€ a la resolución del acuerdo de financiación de fecha de 20 de noviembre de 2023 suscrito entre Nice & Green y la Sociedad. Oryzon ha recibió 1.340.083 acciones propias, incrementado su autocartera hasta 2.374.666 acciones. La valoración de las acciones recibidas por Oryzon en el marco de finalización del acuerdo asciende a 3,8 M€.
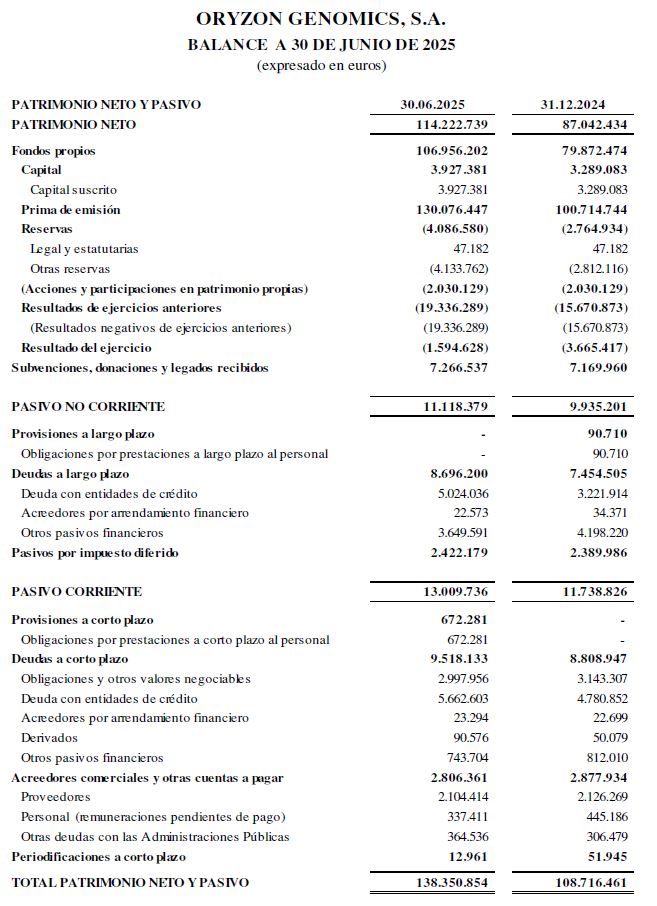
El balance a 30 de junio de 2025 presenta un patrimonio neto de 114,2 M€.
Con fecha 9 de julio de 2025, la Sociedad recibió del Centro para el Desarrollo Tecnológico y la Innovación (CDTI), la resolución definitiva de la convocatoria de ayudas para participantes directos y asociados en el Proyecto Importante de Interés común Europeo de Salud Med4Cure (IPCEI), para la iniciativa“validación de una aproximación de medicina personalizada mediante el uso de inhibidores epigenéticos frente a enfermedades raras”(VANDAM), por un importe final de ayuda concedida de 13.263.794 euros, relativo a un presupuesto de actividades de investigación y desarrollo correspondiente al periodo comprendido entre el 1 de enero del año 2023 y el 31 de agosto del año 2026 por importe de 20.678.376 euros, reconociéndose como hechos posteriores a los Estados Financieros del primer semestre de 2025 diferentes importes estimados con efecto en el Balance, concretamente aumentos en el activo por importe de 14,3 M€, en el patrimonio neto de 4,4 M€ y en el pasivo de 9,9M€.
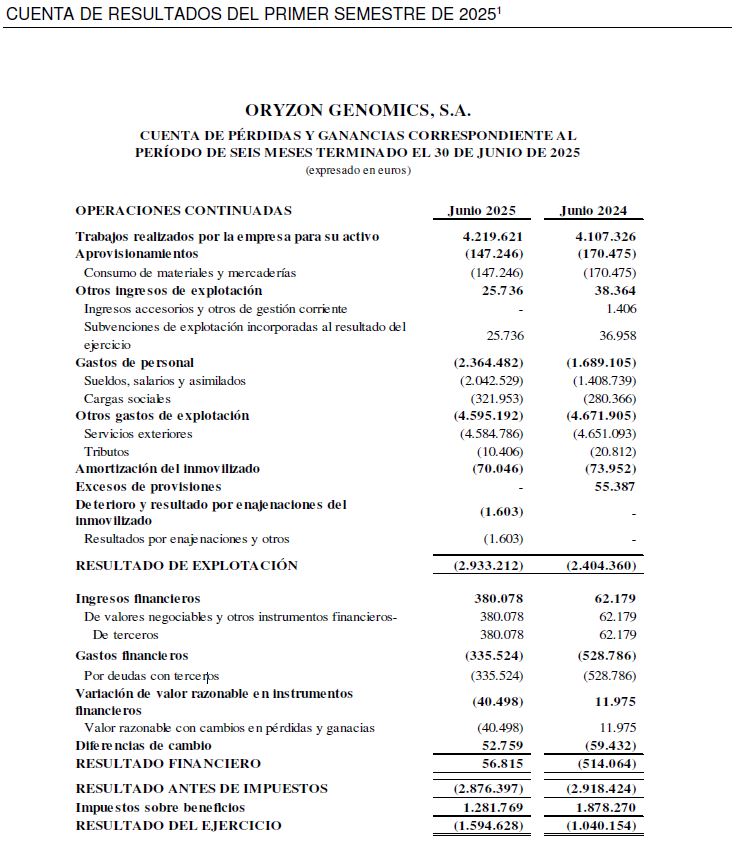
1 Cuenta de resultados no auditada
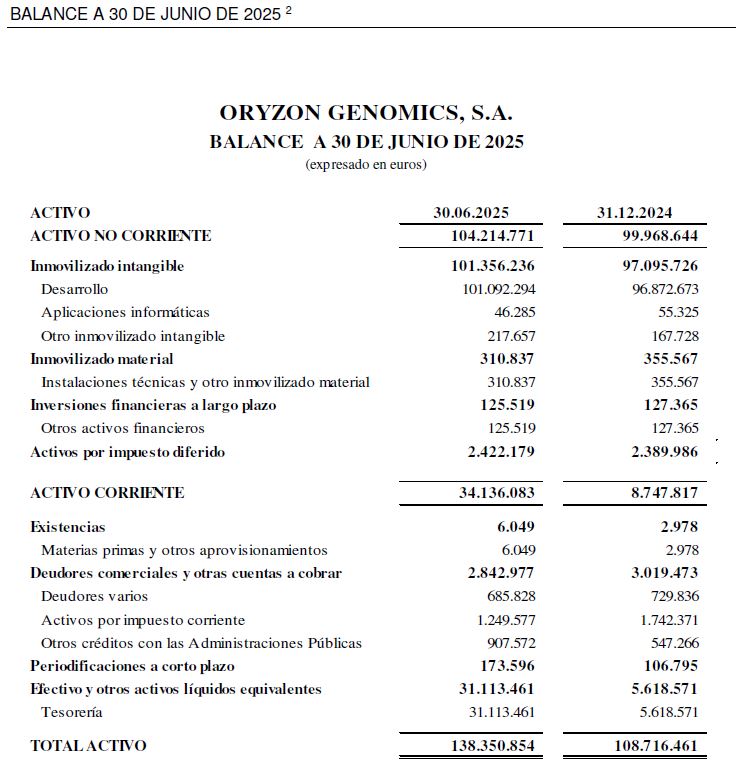
2 Balance no auditado
Sobre Oryzon
Fundada en 2000 en Barcelona, España, Oryzon es una compañía biofarmacéutica de fase clínica líder europea en epigenética, con un fuerte enfoque en medicina personalizada para enfermedades del SNC y oncología. El equipo de Oryzon se compone de profesionales altamente cualificados de la industria farmacéutica, ubicados en Barcelona, Boston y San Diego. Oryzon tiene una cartera clínica avanzada, con dos inhibidores de LSD1, vafidemstat en SNC (listo para Fase III) y iadademstat en oncología (Fase II). La compañía tiene además otros programas dirigidos contra otras dianas epigenéticas como HDAC6, donde ORY-4001 ha sido nombrado como candidato clínico para el tratamiento de ciertas enfermedades neurológicas como CMT y ELA. La compañía posee también una fuerte plataforma para la identificación de biomarcadores y validación de dianas para una variedad de enfermedades oncológicas y neurológicas. Para más información, visitar www.oryzon.com
Sobre Iadademstat
Iadademstat (ORY-1001) es una pequeña molécula oral, que actúa como inhibidor altamente selectivo de la enzima epigenética LSD1 y tiene un potente efecto diferenciador en cánceres hematológicos (ver Maes et al., Cancer Cell. 2018 Mar 12;33(3):495- 511.e12. doi: 10.1016/j.ccell.2018.02.002.). Un primer ensayo clínico de Fase I/IIa con iadademstat en pacientes con LMA recurrente o refractaria demostró la seguridad y buena tolerabilidad del fármaco y señales preliminares de actividad antileucémica, incluyendo una CRi (ver Salamero et al, J Clin Oncol, 2020, 38(36): 4260-4273. doi: 10.1200/JCO.19.03250). Iadademstat ha mostrado resultados alentadores de seguridad y potente actividad clínica en combinación con azacitidina en un ensayo de Fase IIa en pacientes ancianos con LMA de primera línea (ensayo ALICE) (ver Salamero et al., comunicación oral ASH-2022 y The Lancet Haematology, 2024, 11(7):e487-e498). Iadademstat está siendo evaluado actualmente en combinación con gilteritinib en el ensayo de Fase Ib FRIDA en pacientes con LMA refractarios/en recaida con mutaciones FLT3, y en combinación con azacitidina y venetoclax en LMA en primera línea en un ensayo iniciado por investigador (IIS) esponsorizado por OHSU y en un ensayo bajo el Acuerdo de Cooperación en Investigación y Desarrollo (CRADA) firmado con el Instituto Nacional del Cáncer (NCI) de EEUU para colaborar en el desarrollo clínico adicional de iadademstat en diferentes tipos de cánceres sólidos y hematológicos. Más allá de los cánceres hematológicos, la inhibición de LSD1 se ha propuesto como una aproximación terapéutica válida en ciertos tumores sólidos como el cáncer de pulmón de células pequeñas (CPCP), tumores neuroendocrinos (NET), meduloblastoma y otros. En un estudio de Fase IIa en combinación con platino/etopósido en pacientes con CPCP de segunda línea (ensayo CLEPSIDRA), se han reportado resultados preliminares de actividad y seguridad (ver Navarro et al, póster ESMO-2018). Iadademstat está siendo investigado en un ensayo de Fase I/II aleatorizado en CPCP en primera línea en combinación con ICI esponsorizado por NCI y liderado por el Memorial Sloan Kettering Cancer Center. Oryzon está ampliando además el desarrollo clínico de iadademstat a través de estudios clínicos adicionales iniciados por investigadores, y ha anunciado planes de expandir el desarrollo clínico de iadademstat en indicaciones hematológicas no oncológicas como la anemia falciforme (protocolo estudio clínico presentado) y trombocitemia esencial (estudio en preparación). Iadademstat tiene la designación de medicamento huérfano para CPCP en EEUU y para LMA en EEUU y la UE.
Sobre Vafidemstat
Vafidemstat (ORY-2001) es un inhibidor de LSD1 optimizado para SNC activo por vía oral. La molécula actúa a diferentes niveles, reduciendo el deterioro cognitivo, la pérdida de memoria y la neuroinflamación, y además ejerce efectos neuroprotectores. En modelos preclínicos vafidemstat restaura el deterioro cognitivo y elimina la agresividad exacerbada de los ratones SAMP8, un modelo de envejecimiento acelerado y Enfermedad de Alzheimer (EA), a niveles normales y también reduce la evitación social e incrementa la sociabilidad en diferentes modelos murinos. Además, vafidemstat ha mostrado una eficacia rápida, potente y duradera en varios modelos preclínicos de esclerosis múltiple (EM). Oryzon ha llevado a cabo dos estudios clínicos de Fase IIa en agresividad en pacientes con diferentes enfermedades psiquiátricas (REIMAGINE, ver Ferrer et al, Psychiatry & Clin Neurosci, 2025, doi.org/10.1111/pcn.13800) y en pacientes agitados/agresivos con EA moderado o severo (REIMAGINE-AD), con resultados clínicos positivos reportados en ambos. Otros estudios clínicos de Fase IIa con vafidemstat finalizados son el estudio ETHERAL en pacientes con EA leve o moderada, donde se demostró una disminución significativa del biomarcador de inflamación YKL40 tras 6 y 12 meses de tratamiento, y el estudio piloto, de pequeña escala SATEEN en pacientes con EM remitente-recurrente y EM secundaria progresiva, donde también se observó actividad antiinflamatoria. Vafidemstat ha sido evaluado además en un ensayo de Fase II en pacientes graves por Covid-19 (ESCAPE) donde se evaluó la capacidad del fármaco de prevenir el Síndrome de Distrés Respiratorio Agudo, una de las complicaciones más graves de la infección viral, donde mostró efectos antiinflamatorios significativos en pacientes de Covid-19 graves. Vafidemstat está avanzando actualmente como activo listo para Fase III en trastorno límite de la personalidad (TLP) tras la finalización del ensayo global, aleatorizado y doble ciego de Fase IIb PORTICO (datos finales presentados en ECNP-2024). Tras la recepción de la acta de la reunión de Fin de Fase II con la FDA para discutir los resultados de PORTICO, la empresa anunció sus planes para seguir adelante con un ensayo de Fase III, PORTICO-2, en agitación/agresión en TLP (protocolo presentado a la FDA). Vafidemstat está siendo investigado también en un ensayo de Fase IIb doble ciego, randomizado, controlado por placebo en síntomas negativos de la esquizofrenia (el ensayo EVOLUTION; reclutando pacientes). Oryzon también está desplegando un enfoque de medicina de precisión en SNC con vafidemstat en subpoblaciones de pacientes definidas genéticamente de ciertas enfermedades del SNC, así como en síndromes del neurodesarrollo, y está evaluando la viabilidad de realizar ensayos clínicos en trastornos autistas como el síndrome de X frágil y el síndrome de Phelan-McDermid.
AFIRMACIONES O DECLARACIONES CON PROYECCIONES DE FUTURO
Esta comunicación contiene información y afirmaciones o declaraciones con proyecciones de futuro sobre Oryzon. Asimismo, incluye proyecciones y estimaciones financieras con sus presunciones subyacentes, declaraciones relativas a planes, objetivos, y expectativas en relación con futuras operaciones, inversiones, sinergias, productos y servicios, y declaraciones sobre resultados futuros. Las declaraciones con proyecciones de futuro no constituyen hechos históricos y se identifican generalmente por el uso de términos como “espera”, “anticipa”, “cree”, “pretende”, “estima” y expresiones similares.
Si bien Oryzon considera que las expectativas recogidas en tales afirmaciones son razonables, se advierte a los inversores y accionistas de Oryzon de que la información y las afirmaciones con proyecciones de futuro están sometidas a riesgos e incertidumbres, muchos de los cuales son difíciles de prever y están, de manera general, fuera del control de Oryzon, lo que podría provocar que los resultados y desarrollos reales difieran significativamente de aquellos expresados, implícitos o proyectados en la información y afirmaciones con proyecciones de futuro. Entre tales riesgos e incertidumbres están aquellos identificados en los documentos remitidos por Oryzon a la Comisión Nacional del Mercado de Valores y que son accesibles al público.
Se recomienda no tomar decisiones sobre la base de afirmaciones o declaraciones con proyecciones de futuro, ya que se refieren exclusivamente a la fecha en la que se manifestaron, no constituyen garantía alguna de resultados futuros y no han sido revisadas por los auditores de Oryzon. La totalidad de las declaraciones o afirmaciones de futuro de forma oral o escrita emitidas por Oryzon o cualquiera de sus miembros del consejo, directivos, empleados o representantes quedan sujetas, expresamente, a las advertencias realizadas. Las afirmaciones o declaraciones con proyecciones de futuro incluidas en este documento están basadas en la información a disposición de Oryzon a la fecha de esta comunicación.